

●Nodファミリーの謎物語 Nodファミリーの話を中心に、アポトーシスや自然免疫、獲得免疫、細菌と生物の相互作用やそれらの破綻による病気について紹介。随時更新中。
●Nodファミリーの謎物語2 最近の研究を踏まえて新しく追加しました。特に細菌との相互作用について紹介しています。随時更新
●Diary〜研究編 論文の解説から、研究室での出来事や思ったこと、実験失敗談などを書き綴ってます。 随時更新
目次
| 第一章 アポトーシスと炎症 | 第四章 Nodファミリーと細菌の認識 |
| アポトーシスとは | ショウジョウバエの自然免疫〜TollとImd |
| 炎症とは | 細胞表面で病原体から守るTLR |
| アポトーシス実行因子〜カスパーゼ | C-レクチンのシグナル伝達〜CARD9 |
| アポトーシス誘導メカニズム | Apaf-1〜カスパーゼ調節因子 |
| アポトーシスを調節する〜Bcl-2ファミリー | Nodファミリー〜Apaf-1の仲間たち |
| アポトーシスを抑制する〜Clarp | 植物にも同じ仲間が? |
| カスパーゼと炎症性サイトカイン | Nodファミリーの働き〜Nod1とNod2 |
| アポトーシスと炎症のシグナル伝達経路 | Nod1とNod2のリガンド |
| NF-kBとは〜炎症性転写調節因子 | Nod1、Nod2と細菌たちの戦い |
| NF-kBを調節する〜ユビキチンとの関わり | Nod1、Nod2の働いている場所 |
| Nod1、Nod2のシグナル伝達 | |
| 第二章 細菌と私たちの体 | NodファミリーとTLR〜相乗効果とトレランス 工事中 |
| 細菌とウイルス | NodファミリーとASC〜cryopyrinとIpaf |
| 細菌の種類と感染症 | インフラマソームとIL-1bの産生 |
| 私たちの体にはどんな細菌がいるのか? | ASCは癌抑制遺伝子?〜アポトーシスとの関係 |
| 常在細菌の役割 | その他のNodファミリー |
| 腸内細菌も時には悪者になる | 細胞内で働く新たな因子たち〜RIG |
| 常在細菌と健康 | 免疫を逃れる細菌たち |
| 第三章 感染と免疫 | 第五章 細菌とNodファミリーと病気 |
| 自然免疫と獲得免疫 | Nodファミリーの変異と病気 |
| T細胞の機能〜キラーとヘルパー | Nod1とアレルギーと衛生仮説 |
| B細胞の機能〜抗体という武器 | Nod1とASCとC.difficile感染症 |
| サイトカインとは | Nod1と歯槽膿漏 |
| T、B細胞受容体のシグナル伝達〜Bcl-10 | Nod2とクローン病 |
| 自然免疫〜すばやく働く因子たち | 細菌で病気を治す?〜プロバイオティクス |
| 補体のお話 | クローン病の患者さんへ |
| Th17、IL-22 | |
| 自然免疫から獲得免疫へ〜アジュバント活性 | |
| 研究課題〜私の夢 | |
| 最後に〜謝辞 |
| 第一章 アポトーシスと炎症 |
アポトーシスとは
細胞が死ぬことは多くの場合、人や動物が生きていくのに重要なことです。、個体が発生過程で臓器や組織を形作るときや古い細胞を新しい細胞に置き換えるとき、余分な細胞は死んでもらう必要があります。たとえば胎児の手足にはカエルのようにみずかきがありますが、細胞が死ぬことで5本の指になります。また、放射線や薬剤など外界からのストレスをうけたときや最近やウイルスが感染したときも、傷を受けた細胞は増殖するより死んでもらうほうが個体が生きるのに都合がいいはずです。このように、細胞は自爆装置を持っていて除かれるべきときに活性化していわゆる自殺をします。これがアポトーシス(計画的細胞死)です。
アポトーシスではDNAや細胞質は細切れになります。細胞自身の分解酵素が働いて自分自身を分解して、マクロファージ(貪食細胞)に食べられやすくしているのです。こうして死んだ細胞は内容物を外に漏れ出す前に貪食され、周りの正常な細胞に障害を与えることなく速やかに処理されます。このことから、アポトーシスは炎症を引き起こさない細胞死と一般的にいわれています。
炎症とは
炎症反応は異物を破壊・除去し、損傷を修復することです。ウイルスや最近などの異物が侵入すると、それを認識した細胞から炎症誘導因子が放出されて血管が拡張して発赤、熱感が現れたり、血管の透過性が亢進して腫脹が現れたりします。また、異物と戦う白血球が浸潤してきます。これらは、炎症性サイトカインを産生して他の白血球を活性化し、抗体を産生したり、異物の貪食を促進したり、感染細胞にアポトーシスを誘導したりします。異物の除去が終わると、役目を終えた白血球は処理され、損傷を受けた組織は修復されます。
アポトーシスは炎症を誘導しない細胞死と先ほどいいました。たしかに、発生の段階などの細胞死でいちいち発赤や発熱などの炎症が起こっていたらたまったものではありません。しかし、特殊な状況ではあれ、アポトーシスが炎症を誘導す場合もあることもみつかってきました。また、アポトーシスと炎症を分子レベルでみるとたいへん似ているところがあるんです。こうしてみると、アポトーシスと炎症は関係があるのではないかと考えることもできます。
アポトーシス実行因子カスパーゼ
アポトーシスはどうやって起こるのでしょうか?
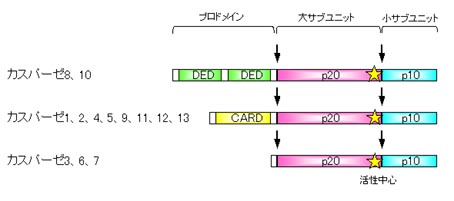
アポトーシスのとき細胞質が細切れになることが重要です。これには細胞自身がもっている分解酵素が働いています。この酵素はカスパーゼと呼ばれていて、哺乳類ではカスパーゼ1からカスパーゼ14まで報告されています。カスパーゼ11, 12はマウス由来、カスパーゼ13はウシ由来で、残りはヒト由来です。どのカスパーゼも活性に重要なシステイン残基(活性中心)を持っていて、アスパラギン酸のとなり(C末)を切断します。
カスパーゼは不活性な状態で合成されて、シグナルがきたときにだけ活性化します。不活性な状態はプロドメインと呼ばれる領域がカスパーゼの活性化を抑制しているからで、シグナルがくるとこれらのドメインが切断されて活性化状態になります。このようなプロドメインをもったものは上流カスパーゼといわれ、カスパーゼ1,2,4,5,8,9,10,11,12,13がこれに相当します。プロドメインにはカスパーゼ調節因子が結合できる領域 を持っていて上流カスパーゼはこれら調節因子が結合することで自分自身を切断して活性化します。
たとえばカスパーゼ調節因子のひとつであるFADDはDEDとよばれる領域をもっていますが、FADDにも似たようなDED領域をもっていて、FADDのDED領域がカスパーゼ8のDED領域に結合してカスパーゼ8を活性化します。このように似たような構造をもったものどうしが結合するのです。また、Apaf-1はCARDとよばれる領域をもったカスパーゼ調節因子で、やはり似たようなCARD領域をもつカスパーゼ9に結合して活性化します。
これに対し下流カスパーゼはプロドメインが短いため調節因子に結合できず自分自身で活性化することができません。これらのカスパーゼは上流カスパーゼによって切断されて活性化します。カスパーゼ3,6,7,14がこれに相当します。活性化した下流カスパーゼはさまざまな基質を切断してアポトーシスを実行します。
アポトーシス誘導メカニズム
それでは、細胞はどうやって「死ぬぞ」というシグナルを伝えるのでしょうか。
紫外線や薬剤などのストレスをうけると細胞内に存在するがん抑制遺伝子p53が活性化して、細胞死を誘導するように働きかけます。このときミトコンドリアからチトクロムcが流出します。これがカスパーゼ調節因子であるApaf-1に結合して活性化しカスパーゼ9を活性化してアポトーシスを起こします。
また、死受容体は細胞表面でシグナルをまっていて、免疫系などの細胞から提示されるTNFやFasリガンドなどに応答して細胞死を誘導します。シグナルをうけた死受容体はTRADDやFADDといったアダプター分子を介してカスパーゼ8を活性化します。
先ほど、カスパーゼ9やカスパーゼ8は上流カスパーゼであり自分自身を切断して活性化することを述べました。Apaf-1やFADDはこれらのカスパーゼと結合し、カスパーゼ同士を近づけることによって切断し、活性化させる役割を果たしています。
アポトーシスを調節する〜Bcl-2ファミリー
実際には死ぬということはこんなに簡単ではありません。細胞内には本当に死んでいいのか生きるべきなのか判断するアポトーシス制御因子が存在します。
Bcl-2ファミリータンパク質はアポトーシスのシグナルのオン/オフを決定をします。Bcl-2ファミリーとはBH領域とよばれる領域をもった因子群のことをさし、これまでに30以上のタンパク質が見つかっています。これらは、アポトーシスを促進するほうに働くもの(たとえばBaxやBid)と、抑制するほうに働くもの(たとえばBcl-2やBcl-xL)の大きく2つに分けられます。両者の細胞内でのバランスによって細胞が生きるか死ぬかが決定されます。
それではBcl-2ファミリー蛋白質はどのように調節されているのでしょうか?
一つに転写による量的調節があります。インターロイキンなどの生存因子やSTAT、NF-kBなどの転写調節因子によってBcl-2ファミリータンパク質はの発現が調節されています。
二つ目にリン酸化や切断などの修飾による調節です。たとえばBidはカスパーゼ−8によって切断されて活性化しますし、Badは通常リン酸化されていますが、脱リン酸化することで活性化します。
また、Bax、Bakは立体構造変化が重要であることがいわれています。
タンパク質名 機能 活性調節 その他 Bcl-2 抑制 転写調節(NFAT4、GATA-1、STAT3など) インターロイキンやG-CSFなどの生存因子により活性化。リンパ球などの成熟に伴う細胞死を抑制。 Bcl-XL 抑制 転写調節(GATA-1、NF-kB、STATファミリーなど) IL-3、GM-CSFなどの生存因子により活性化。神経・造血系など成熟に伴う細胞死を抑制。 A1 抑制 転写調節(NF-kB、STAT) GM-CSFやLPSにより活性化。マクロファージ成熟に伴う細胞死を抑制。 Bax 促進 構造変化、転写調節(p53) p53応答細胞死。細胞死増強。 Bak 促進 構造変化、転写調節(p53) p53応答細胞死。細胞死増強 Harakiri 促進 転写調節 NGFやIL-3などの生存因子除去により活性化。 Bad 促進 リン酸化による直接調節 通常リン酸化して14−3−3に結合。生存因子除去により脱リン酸化し活性化。 Bid 促進 カスパーゼ8により切断 デスレセプターからの細胞死誘導の増強。 Bim 促進 リン酸化による間接的調節 通常細胞骨格タンパク質に結合。生存因子の除去により離れて活性化。
Bcl-2ファミリーはミトコンドリアからチトクロムcの流出を促進したり抑制したりすることでアポトーシスを制御します。先にも言ったようにチトクロムcが流出してApaf-1に結合するとカスパーゼ9を活性化してアポトーシスを起こします。だとすると、FasやTNFを介したアポトーシスでは直接カスパーゼ8を活性化するのでBcl-2ファミリーの制御はうけないと思われますが、実際にはミトコンドリアの経路を介してアポトーシスシグナルを増幅していると考えられています。活性化したカスパーゼ8はアポトーシス促進型Bcl-2ファミリー因子であるBidを切断します。これによりBidは活性型になりミトコンドリアからチトクロムcを流出してアポトーシスを誘導します。
アポトーシスを抑制する〜Clarp
カスパーゼ8はそのDED領域を介してFADDのDEDに結合して活性化することはお話しました。
このカスパーゼ8に似た分子が存在します。Clarp(cFLIP)とよばれる因子です。Clarpはスプライシングによって短いものと長いものの二種類が存在。Clarp(S型)はカスパーゼ8と似たようなDED領域を2つもちますが、カスパーゼ活性を示す領域をもっていないので、活性化することができません。また、Clarp(L型)はカスパーゼ8と同じようにDED領域とカスパーゼ領域に似た領域をもっていますが、酵素活性をもっていません。よって、ClarpはFADDやカスパーゼ8に結合しますが、アポトーシスを誘導することができません。つまり、Clarpは「おとり」として働いており、カスパーゼ8を介したアポトーシスを抑制しているのです。
カスパーゼと炎症性サイトカイン
これまでの話でわかるように、カスパーゼはアポトーシス誘導にたいへん重要な因子です。しかし、カスパーゼはアポトーシスに関与するだけでなく、炎症反応にも関与しているのです。
炎症誘導に関与するものにはカスパーゼ1、5、11が含まれます。カスパーゼ1と11は炎症誘導因子(炎症性サイトカイン)の産生に重要な働きをもちます。ヒトのカスパーゼ5はマウスのカスパーゼ11に対応する遺伝子であると考えられています。
炎症性サイトカインは好中球の浸潤を誘導し炎症を起こします。この炎症性サイトカインの代表的なものにIL-1βがあります。通常IL-1βは不活性な状態で存在していています。これはプロドメインが活性を抑制しているからで、この領域が切断されると活性型となって細胞外に放出されます。別の炎症性サイトカインIL-18も同様の機構で活性化されます。これらのプロドメインを切断するのがカスパーゼ1なのです。カスパーゼ1の活性化にカスパーゼ11が必要であることもいわれています。
カスパーゼはアポトーシスを誘導するし、炎症性サイトカインの活性化も制御するのです。
こうしてみると、アポトーシスと炎症は似てますよね。
アポトーシスと炎症のシグナル伝達経路
アポトーシスと炎症の関連性は他にもあります。
先ほどTNFによるアポトーシス誘導メカニズムについてお話しました。TNFはアポトーシス誘導因子であり、炎症性サイトカインでもあります。TNFがTNF受容体に結合すると受容体はTRADD、FADDとよばれるアダプター分子を介してカスパーゼ8を活性化し、アポトーシスを誘導します。しかしその一方で、TRADDはRIPとよばれるアダプター分子を介してNF-kBの活性化も誘導します。NF-kBはサイトカインの転写を活性化して炎症や免疫反応を起こします。このことは、ひとつの受容体からアポトーシス誘導のシグナルと炎症誘導のシグナルの2つのシグナルがでるということになります。
こうしてみると、やはりアポトーシスと炎症は関連がありそうですよね。
NF-kBとは
NF-kBについてもう少し詳しく説明しておきます。
NF-kBは転写因子の一つで、さまざまなサイトカインやアポトーシス関連因子の転写を活性化します。
NF-kBはファミリーを形成していて大きく2つに分けられます。ひとつは転写を活性化するサブファミリーでRel様領域(RHD)と転写活性化領域を持っていて、ヒトではRelB、cRel、p65、p100、p105の5つが含まれます。もうひとつはアンキリンリピートをもったI-kBサブファミリーでこれらの因子は転写活性化を抑制するほうに働きます。
NF-kBは自分自身や他の因子と結合して二量体をつくって活性化します。通常この複合体はさらにI-kBと結合していて活性が抑制されています。何らかの刺激が入ると、I-kBはリン酸化して分解されてNF-kB複合体から離れます。これによってNF-kB複合体は活性化されて核内に移動し、標的の遺伝子の転写を活性化します。
p100、p105はN末側にRHD、C末側に抑制領域であるアンキリンリピートの両方を持っています。これらの因子はプロテアソームで限定分解されることでアンキリンリピートが切断(プロセッシング)されて活性型になります。
NF-kBの活性化機構は大きく2つにわけられ、それぞれcanonical 経路 、 non-canonical 経路とよばれています。これはNF-kBの活性化がI-kBの分解によるかp100のプロセッシングよるかでわけられています。
canonical 経路は一般的なNF-kB活性化経路でTNFαや後でお話しするIL1/Toll-likeレセプター、T細胞受容体(TLR)、によるNF-kB活性化経路などがこれにあたります。この経路ではIKKサブユニット(IKKα、β、γ(NEMO))が活性化されてI-kBのリン酸化を誘導し、リン酸化されたI-kBはユビキチン化により分解されてNF-kBが離れて活性化します。(リン酸化、ユビキチン化については次の項で詳しくお話します。)
non-canonical 経路にはBAFF、リンフォトキシンβ、CD40リガンドによるものがあります。これらはプロテインキナーゼのNIKを活性化してIKKαを活性化します。これによりp100のC末がリン酸化されて、I-kB同様ユビキチン化により分解されて活性化型のp52になり、RelBとともに核に移行して活性化します。
NF-kB活性化を調節する〜ユビキチン化とのかかわり
たんぱく質が修飾を受けることは、シグナル伝達において重要な役割を果たします。修飾のひとつにはリン酸化があります。たとえば、先にもお話したようにNF-kBの抑制因子であるI-kBはリン酸化をうけることによって分解されます。そしてもうひとつ重要なのが、ユビキチン化です。不要になったたんぱく質がユビキチン化をうけてプロテアソームで分解されるということは、昔からよく知られている機能です。I-kBのユビキチン化はこれにあたります。しかし、近年ユビキチン化には分解以外の重要な機能があることがわかってきました。
まず、ユビキチン化とはどういったものかお話します。
ユビキチンは76個のアミノ酸からなるタンパクです。ユビキチン化は3つのステップからなります。そこで働くのが、ユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチン連結酵素(E3)です。E1はユビキチンを活性化してE2にわたしていきます。E2はそれをE3に結合している標的のタンパク質に結合させます。
典型的なユビキチン化はユビキチンのリシンの48番目(K48)を介して標的タンパクに結合され、プロテアソームに運ばれて分解されます。先ほどからお話しているIkBαの分解もこれです。
しかし、リシンの63番目(K63)を介してユビキチンが結合されることがあることがわかってきました。この特別なユビキチン化はたんぱく質分解を誘導しません。ユビキチン鎖が下流のタンパク質との結合ドメインとして働いて、シグナルを伝達するのに重要であるといわれています。
NF-kBのシグナル伝達においても、K63のユビキチン化が重要な役割を果たしていることがわかってきました。
TNFの下流にあるTRAF2や後でお話しするIL1/Toll-likeレセプター、T細胞受容体(TLR)の下流にあるTRAF6は(RINGドメインとZinc-fingerドメインをもっていて)ユビキチンE3であることが報告されています。これらのたんぱく質はE1、E2(UBC13またはUEV1A)とともにK63ユビキチン化を誘導します。
これらの下流にある、RIP/TRAF2やTRAF6はシグナル伝達の過程でユビキチン化されます。ユビキチン化されたRIPやTRAF6は下流のTAK1複合体と(TAB2のZinc-fingerドメインを介して)結合し、TAK1の自己リン酸化を誘導して活性化し、IKKβのリン酸化を誘導して活性化します。
またNEMO(IKKγ)もユビキチン化され、これがNF-kBの活性化に重要であると言われています。
一方、脱ユビキチン化酵素が存在します。NF-kBのシグナルにおいては2つの脱ユビキチン化酵素CYLD、A20が報告されていて、これらの脱ユビキチン化酵素によってNF-kBの活性化が抑制されます。
A20やCYLDはRIPやTRAF2、TRAF6、NEMOのK63のユビキチン鎖を切断することによってIKKの活性化を抑制します。
A20はNF-kBによって誘導されるたんぱく質であるのでNF-kBのネガティブフィードバックをしていると考えられます。
A20はOTUドメインとZinc-fingerドメインをもっていてOTUドメインはRIP、TRAF6のK63のユビキチン化を切断し、IKKの活性化を抑制します。さらにA20はRIPのk63のユビキチン化を取り除いた後あと、Zinc-fingerドメインによってK48のユビキチン化を誘導しRIPの分解を促進して、さらにIKKの活性化を抑制するとも言われています。
このように、ユビキチン化と脱ユビキチン化はNF-kBのシグナル伝達を調整するのに重要であることがわかります。
| 第二章 細菌感染と免疫 |
細菌とウイルス
この章では免疫のお話をします。
細菌やウイルスなどさまざまな病原体が食べ物や空気中に舞って体の中に浸入して、組織内で増殖して、感染が起こります。この感染の成立は病原体と人(宿主)の生態防御応答のせめぎあいで、感染を防ぐために免疫機構があります。免疫機構は感染を防ぐだけでなく、感染後の治療、再感染の防止にも働いています。
まず、細菌、ウイルスとはどんなものか説明しましょう。
全細菌に共通した基本構造として、角膜のないゲノムDNAとリボソームを脂質二重層からなる細胞質膜が包み、さらに外側に細菌特有の細胞壁が存在します。細胞壁の基本構成成分はペプチドグリカンでN-アセチルグルコサミン(GluNAc)とN-アセチルムラミン酸(MurNAc)が交互にβ-1,4結合した基本骨格と、MurNAcに結合したAla-Glu-Lys(またはmDAP)-Alaのテトラペプチド(ペプチドの構成は細菌によって異なる)をGlyが架橋し全体として網目状構造をとります。
細菌をグラム染色法で染色すると青紫に染まるものをグラム陽性菌、赤色に染まるものをグラム陰性菌とよんでいます。グラム陽性菌は細胞壁が厚いのに対して、グラム陰性菌の細胞壁はきわめて薄いですが、グラム陽性菌にはない外膜が存在しています。外膜の外側脂質層はリポ多糖(LPS)があり、リピッドA、コア多糖、O抗原多糖からなっています。グラム陰性菌には繊毛を持つものがあり、泳ぐものがいます。
ウイルスとは、生きた細胞に感染してその酵素などを借りなければ自己複製、増殖できない微小病原体です。もっとも単純なウイルスはゲノム核酸(DNAまたはRNA)と核酸をとりまくカプシドたんぱく質のみから構成されます。多くのウイルスはさらに脂質二重膜のエンベロープを被っています。
細菌の種類と感染症
細菌の種類についてもう少し詳しく見てみましょう。
一口に細菌といってもいろいろいます。
形を見ても、球菌、桿菌、らせん菌の3基本形に分けられ、またこれらも、ブドウ球菌、レンサ球菌、双球菌など、配列の仕方に違いがあります。
また、細菌が生きるのに、酸素を要求するものや無酸素状態を要求するものなどさまざまです。偏性好気性菌 : 増殖のために酸素を必要とするもの。偏性嫌気性菌 : 酸素の存在が有害であるもの。通性嫌気性菌 : 酸素の有無に関わらず増殖するもの。のように分類されています。
中には毒素を持っていて、感染症を引き起こす細菌もいますが、非病原性で私たちの体の中や環境中に常在している細菌も多く存在します。
一部の細菌についてあげてみました。
細菌属 特徴 細菌名 細菌の特徴 など 関連する感染症
グラム陽性菌
バチラス属
Bacillus通性嫌気性
桿菌
胞子形成する
ほとんどは非病原性
土壌に多く存在納豆菌
B.subtilis土壌に多く存在
納豆に利用非病原性 セレウス
B.cereus環境中に存在
外毒素Hbl, Nhe, cytKをもつ下痢型と嘔吐型がある。芽胞は加熱にも耐えるので、食中毒の原因菌になる。 炭疽菌
B. anthracis毒素プラスミドpXO1をもつ(外毒素PA, EF, LFをコード) すり傷などから侵入して皮膚炭疽、ほこりや食物とともに摂取することによって肺炭疽、腸炭疽を引き起こす。 ビフィドバクテリウム属
Bifidobacterium偏性嫌気性
桿菌
非病原性
腸内常在細菌B. breve ヨーグルトによく用いられる 非病原性 B. longum 腸内常在細菌 非病原性 B. adolescentis 腸内常在細菌 非病原性 クロストリジウム属
Clostridium偏性嫌気性
桿菌
胞子形成する
ほとんどは非病原性C. tetani 土壌中に芽胞の形で多く存在。テタヌストキシンを産生 傷口から感染し、破傷風の原因になる。 C. perfringens . 腸内常在菌。
一部の菌種は毒素を産生食中毒の原因になる。また傷口に感染して、重篤なガス壊疽を起こす事もある。 C. botulinum 土壌中などに存在。
ボツリヌストキシンを産生真空パックの食品内部で増殖して摂取によりボツリヌス食中毒を起こす。ハチミツなどに含まれる芽胞が乳児の腸内に定着する乳児ボツリヌス症なども起こす。 C. difficile 腸内常在細菌 抗生物質に比較的抵抗性で、抗生物質大量投与時に、他の腸内細菌が死滅したときに過剰に増殖して(菌交代症)、偽膜性大腸炎の原因になる。 ラクトバシラス属(乳酸菌)
Lactobacillus通性嫌気性
桿菌
乳酸を産生腸内常在細菌 非病原性 デーデルライン桿菌Doderlein 膣内常在細菌 非病原性 L. acidophilus ヨーグルトに用いられる 非病原性 L. casei ヨーグルトに用いられる 非病原性 リステリア属
Listeria通性嫌気性
桿菌
細胞内寄生細菌L. monocytogenes リステリオリジンOを産生して、ファゴソーム膜を破壊して細胞質に抜け出し、殺菌機構から逃れる 本菌に汚染された食物を摂食した後に髄膜炎や敗血症を発症する。感染した母体から胎盤を介して胎児に感染して、流死産や胎児敗血症、また新生児髄膜炎や新生児敗血症の原因になる。 プロピオニバクテリウム属
Propionibacterium桿菌 P. acnes にきびの原因 ブドウ球菌属 Staphylococcus 通性嫌気性
球菌。ぶどうの房状。
常在細菌。病原体の侵入を防ぐバリヤーの役割の一端を担っている。黄色ブドウ球菌
S. aureus鼻腔や表皮に常在
外毒素TSST-1をもつ。皮膚感染症。肺炎、肺化膿症。嘔吐を伴う食中毒。毒素性ショック症候群。 S. epidermidis 鼻腔や表皮に常在 通常、非病原性。まれに手術の際に体内に侵入して化膿症の原因になることがある。 S. saprophyticus 泌尿器周辺の皮膚に常在 尿路に侵入して尿路感染症の原因になることがある。 レンサ球菌属 Streptococcus 通性嫌気性
連鎖球菌肺炎球菌S.pneumoniae α溶血性
双球菌肺炎などの局所性、敗血症、髄膜炎など全身性感染症を引き起こす。 S. pyogenes β溶血性 咽頭扁桃炎、急性糸球体腎炎新生児の細菌性髄膜炎、敗血症 S.mitis γ溶血性。口内常在細菌。 問題になることはない グラム陰性菌 バクテロイデス属
Bacteroides
偏性嫌気性
桿菌B. fragilis など 腸内常在細菌 非病原性。
まれに日和見感染が起こることがある。ボルデテラ属
Bordetella偏性好気性 百日咳菌
B. pertussis外毒素PT 百日咳の原因菌 大腸菌属 (エシェリキア属) Escherichia 通性嫌気性
桿菌E. coli 腸内常在細菌 非病原性のものとO157のように病原性で下痢や腸炎を起こすものがある フランシセラ属
Francisella偏性好気性 野兎病菌
F. tularensis人畜共通感伝染病菌
感染力がきわめて強い波状熱、頭痛、悪寒、吐き気、嘔吐、衰弱、化膿、潰瘍 ヘリコバクター属
Helicobacterらせん菌 ピロリ菌
H. pyloriウレアーゼを産生する。尿素を分解してアンモニアを作り、胃酸を中和。 慢性胃炎、胃潰瘍や十二指腸潰瘍、胃癌やMALTリンパ腫を引き起こす。 クレブシエラ属
Klebsiella通性嫌気性
桿菌肺炎桿菌
K. pneumoniae肺炎、腹膜炎、菌血症、敗血症などを起こす場合がある。日和見感染や菌交代症の原因菌。 レジオネラ属
Legionella好気性
桿菌
細胞内寄生細菌レジオネラ
L. pneumophila食胞膜を変化させて殺菌機構を逃れ、肺胞マクロファージ内で増殖することが可能 肺胞マクロファージに感染することによって発病。レジオネラ感染症(レジオネラ肺炎およびポンティアック熱)の原因になる。 ナイセリア属
Neisseria好気性
双球菌
淋菌、髄膜炎菌以外は口内常在細菌淋菌
N. gonorrhoeae淋病(性感染症) 髄膜炎菌
N. meningitidis髄膜炎 シュードモナス属
Pseudomonas
偏性好気性
桿菌緑膿菌
P. aeruginosa土壌、水などの環境中や消化器官に存在する
外毒素Aを産生健常人には感染しないが、免疫力が低下すると緑膿菌感染症(日和見感染)を引き起こす。 P. putida 水まわりに存在 非病原性 サルモネラ属
Salmonella通性嫌気性
桿菌
細胞内寄生細菌S. Typhi III型分泌機構をもち、細胞質内にエフェクター分子を注入する マクロファージに感染して菌血症を引き起こす S. Typhimurium 腸管上皮細胞に感染して胃腸炎を起こす シゲラ属
Shigella通性嫌気性
桿菌
細胞内寄生細菌S. dysenteria
S. flexneri
S. boydii
S. sonneiIII型分泌機構をもち、細胞質内にエフェクター分子を注入する
シガトキシン(外毒素)を産生赤痢(下痢、発熱、発熱を主症状とし、しばしば、しぶり腹を伴う膿粘血便が見られる。) ビブリオ属
Vibrio通性嫌気性
桿菌
好塩性
アルカリ性コレラ菌
V. choleraeコレラ毒素を産生 O1型のコレラ菌はヒトに経口感染してコレラの原因になる。非O1型コレラ菌は感染性胃腸炎の原因になる。 腸炎ビブリオ
V. parahaemolyticus溶毒素(TDH,TRH)をもち細胞膜に作用して、細胞傷害を起こす 食中毒の原因 エルシニア属
Yersinia通性嫌気性
桿菌ペスト菌
Y. pestisペスト(リンパ節が腫れる、敗血症、肺炎、潰瘍)
私たちの体にはどんな細菌がいるのか?
私たちの体にはいっぱい細菌がいます。私たちの細胞の10倍いると言われています。とくに腸内には人それぞれ違うけど、腸内容物あたり数千万〜数十億の細菌が住んでいます。しかも数千種類いて、人それぞれで違ったりして。私たちは、彼らとときに仲良く、ときに喧嘩しながらつきあっているのです。
生まれた赤ちゃんには細菌がいない(germ-free)ですが、生まれたとたんにお母さんや周りから細菌が付着したり、おなかの中に入ってきます。特に破水して赤ちゃんが生まれてくるお母さんが生まれてくる途中では、子宮下部、膣を通るわけですが、そこにはたくさんの細菌がいます。大半のお母さんは病気になりにくい細菌たちをもっていて、赤ちゃんは無事お母さんからいろいろな細菌をもらいます。帝王切開で生まれた赤ちゃんも、お母さんなどと触れ合うことでたくさんの細菌をもらいます。
腸にはどんな細菌がいるか見てみましょう。
小腸は乳酸菌やプロテオバクテリアが多く、大腸ではバクテロイデス目やクロストリジウム目が増えてきます。 細菌の多くは私たちと同じ栄養物を食べることができるからです。 腸内にいる大腸菌などのエンテロバクテリアは無機窒素化合物があれば、自分でタンパク質の素であるアミノ酸を全て作ることができます。ところが、腸内の乳酸菌(Lactobacillus)なんかになるとアミノ酸を合成する酵素を全て揃えておらず、独りでは生きていけないです。だから、栄養がいつも来るような状態で細菌が住んでいるのです。小腸の細菌は自分で栄養物が作れようが作れまいが、私たちのご飯の横取りをして生きているんです。ところが、私たちが栄養を小腸で吸収すると、今度は彼らの栄養が少なくなります。 でもバクテロイデス目やクロストリジウム目は平気です。 なぜなら、人が分解できないような食物繊維を食べることができるから。 セルロース、キシランやキチンなど糖が繋がった多糖体を1つ1つの単糖へと分解する酵素を持っていて栄養にできるのです。さらに腸内の粘膜分泌物、ムキンの糖も壊して食べるものもいます。
常在細菌の役割
常在細菌は人が自分で分解できない食物を分解し、栄養物として腸から吸収できるようにします。常在細菌は私たちの体になくてはならないものなのです。
さらに常在細菌は病原菌から守るのにも重要な働きをしています。
ささっと生えることで他の細菌、たとえば病原菌に打ち勝つことができます。単糖・二糖やアミノ酸、鉄といった一般的な栄養要素のような環境因子について常在細菌たちは互いに、そして病原と競合するのです。
また細菌は一旦成長すると自分に適した環境を作ります。例えば、乳酸菌の仲間は乳酸を出し、弱酸性の環境を作ります。そうすると中性のpHの好きな細菌は生えにくくなります。
こうした増殖性、pHシフトは相手を倒すのに使える戦略です。さらに、過酸化水素水H2O2を生産するやつもいます。抗生物質を出して競争相手を殺すやつもいます。腸内では、自分と似た細菌を殺すバクテリオシンBacteriocinsと呼ばれる、タンパク質性の対細菌用の毒を出すものもいます。対細菌用の毒ですので、ヒトには効かないものがほとんどで、近似種によく効き、無毒な乳酸菌やプロテオバクテリアなんかももっています。
常在細菌も時には悪者になる
しかし、私たちの体にいる細菌は必ずしもいい細菌はありません。善玉細菌とか言われているような細菌でも、私たち宿主の組織内に入ってくると炎症を起こすものです。 たとえば、腸が傷ついて、腸から細菌が入り炎症を起こすと、敗血症、心内膜炎などの障害を起こして死に至ることもあります。従って、常在細菌はいい細菌と悪い細菌としての顔を持っているといえます。
また、常在細菌は病原の発育を助けることもあります。病原菌Citrobacter rodentiumは、人の病原性大腸菌と同じようにマウスの大腸に感染するエンテロバクテリア科の細菌ですが、腸上皮にくっついて炎症や障害を起こして栄養を摂ります。これはエンテロバクテリア属の餌を食べてしまう腸内細菌が存在するときだけ起きます。このように腸内細菌は決して、病気を防ぐだけではないです。
常在細菌と健康
自然免疫と獲得免疫
このような細菌やウイルスなどの病原微生物の浸入に対する生体防御機構には、自然免疫よばれるものと獲得免疫とよばれるものがあります。
自然免疫とは微生物感染時に迅速に機能する免疫応答機構で昆虫から哺乳類まで幅広く存在します。一方、獲得免疫は哺乳類などの高等動物だけがもっています。
獲得免疫はB細胞やT細胞といったリンパ球によって行われていて、多彩な抗原受容体を形成することで高い親和性でかつ特異的に抗原を認識します。また、リンパ球はこのときの出来事を記憶しておくことができるので、再び同じ抗原がやってきたときに強い免疫応答を起こすことができます。しかし、獲得免疫が成立するのには通常、感染してから数日かかってしまいます。
そこで感染初期に重要なのが、自然免疫です。自然免疫機構は獲得免疫ほど特異性や親和性は高くありませんが、外来微生物の分子パターンを認識できます。また、自然免疫は異物を排除するだけでなく、その後の獲得免疫の成立にも重要な役割を果たしています。
このように、高等動物では自然免疫と獲得免疫が協調して働いて感染に対処しているのです。
T細胞の機能〜キラーとヘルパー
まず獲得免疫のお話をします。
獲得免疫は体液性免疫と細胞性免疫に大きく分かれ、前者はB細胞による抗体産生による免疫機構、後者は抗体の関与なしにT細胞によって行われる免疫機構です。
B細胞もT細胞も抗原と反応することによって免疫応答を示します。これらの表面には抗原と1対1で反応する抗原レセプターを持ちます。
T細胞の働きには、1)ウイルス感染細胞、腫瘍細胞、移植細胞を破壊すること、2)マクロファージなどを活性化するサイトカインを産生して菌や異物を処理する反応を起こさせること、3)B細胞や他のT細胞の働きを補助したり抑えたりして調節すること、があります。
このようにT細胞にはいくつかの機能があり、細胞を殺す働きをするT細胞をキラーT細胞とよびます。キラーT細胞が十分働くよう助けているT細胞をヘルパーT細胞と呼びます。
成熟したT細胞は細胞表面にCD4分子を持つものとCD8分子を持つものがありますが、ヘルパーT細胞はCD4、キラーT細胞はCD8を持つものに属しています。
CD4分子を持つT細胞はどのサイトカインを産生するかによってわけられ、インターフェロンγ、インターロイキン2をつくるTh1細胞とインターロイキン4、5、10、13などをつくるTh2細胞があります。Th1はマクロファージを活性化したり、キラーT細胞の発現を助けたりして炎症反応の誘導に関与するのに対し、Th2はB細胞を活性化し、IgE産生を介するアレルギー反応など抗体産生応答に関与します。
細胞表面には固体ごとに違った抗原が存在し、他人の組織を移植するとその抗原に対する免疫応答が生じて移植拒絶反応を起こします。このような細胞表面の抗原を組織適合抗原とよびます。中でもっとも主要な役割を果たしているのが主要組織適合抗原であり、それを決定する遺伝子群をMHCといいます。MHCによる抗原には、ほとんどの組織に存在するクラスIとB細胞・マクロファージ・樹上細胞など一部の細胞にしか存在しないクラスIIとがあります。
T細胞レセプターは抗原ペプチドがMHC分子に結合したものを認識します。外来性の抗原と反応するときにはMHCクラスIIを発現している抗原提示細胞(マクロファージ・樹上細胞など)の存在が必要で、MHCクラスIIとその抗原ペプチドの組み合わせに反応します。一方、ウイルス抗原のように細胞内で産生された抗原ペプチドはMHCクラスIと抗原ペプチドの組み合わせに応答します。CD4をもつT細胞はMHCクラスII、CD8をもつT細胞はMHCクラスIを利用します。
Th1 Th2 キラーT細胞 表面分子 CD4 CD4 CD8 認識抗原 感染細胞(マクロファージ)上のペプチド抗原とMHCクラスII複合体 B細胞上のペプチド抗原とクラスII複合体 感染細胞上の抗原ペプチドとクラスI複合体 機能発現分子 IFNγ、IL-2、GM-CSF、TNFα IL4、IL-5、IL-10、IL-13 パーフォリン、グランザイム、FasL
T細胞のシグナル伝達の分子機構ははあとで詳しくお話しましょう。
B細胞の機能〜抗体という武器
B細胞は抗体を合成して分泌する役割を持ったリンパ球です。
抗体とはどんなものでしょうか。
微生物など(抗原)が体に入ってくると、それに対して抗体がつくられ、抗原に結合し、それから体を守る働きをします。ある特定の抗原に対して作られた抗体はその抗原とは結合しますが他の抗原とは結合しません。鍵と鍵穴の関係のように厳密なのです。
抗体分子は4本のポリペプチドからできていて2本は長くてH鎖といい、2本は短くてL鎖といいます。H鎖とL鎖が対になっている部分をFabといい、H鎖2本でできている部分をFcといいます。Fab2つとFc1つでY字型の構造になっています。抗体は2箇所のFabで抗原に結合します。Fabの端から半分までのアミノ酸配列は抗原ごとに異なっていて、これが抗原特異性を示すことになります。Fabの残り半分とFcのアミノ酸は抗原が違ってもほとんど変わりません。それぞれの領域を可変領域、定常領域とよんでいます。
抗体は無数に存在する抗原それぞれに対して異なったものがつくられなくてはならないので抗体をつくるために無数の遺伝子が必要になることになります。そこで、限られた遺伝子で多数の遺伝子を用意するため遺伝子の再編成という方法をとっています。
H鎖の可変領域にはV、D、Jの3つの領域の遺伝子がありそれぞれ約1000種、10種、4種の遺伝子からひとつずつ選び出して組み合わせて新しい遺伝子を作ります(1000x10x4種類)。L鎖はV領域300種、J領域4種から組み合わせてつくり(300x4種類)、両方をあわせると無数の遺伝子が作られるわけです。
また、抗体はH鎖の定常領域が少しずつ異なっていることによって5つのクラスIgM、IgD、IgE、IgG、IgAに大別されます。IgGはさらにIgG1、IgG2、IgG3、IgG4、のサブクラスに分けられます。最初はIgMが産生されますが、IgMのものからIgGのもの、IgAのものと、ひとつの細胞がそれぞれのクラスのものへと作り変えていきます。これをクラススイッチと呼びます。
クラススイッチを誘導するのにヘルパーT細胞の働きが必要です。ヘルパーT細胞がどのようなサイトカインを産生してB細胞に作用させるかでつくられる抗体のクラスがかわります。TGF-βはIgAに、IL-2、IL-4はIgG1に、インターフェロンγはIgG2Aスイッチします。アレルギーの原因になるIgEはIL-4、IL-13によって促進、IL-5、IL-6によって増強され、インターフェロンγによって抑制されます。このことは、前者を産生するTh2細胞と後者を産生するTh1細胞とのバランスがIgE産生を左右すると考えられます。
T、B細胞受容体のシグナル伝達〜CARDタンバク質の働き
ここで、T細胞やB細胞のなかでどのように情報が伝えられているのか、分子メカニズムを見てみましょう。
T細胞受容体(TCR)、B細胞受容体(BCR)が、提示された病原の一部を認識すると次の免疫反応を誘導する情報伝達物質を合成します。この情報伝達物質の合成にはNF-kB活性化が必要です。TCRは細胞の中 へのCa2+イオンの流入を引き起こし、その後、Ca2+依存性でタンパク質をリン酸化する 酵素であるPKCを活性化し、ついでPKCがNF-kBを活性化します。
このNF-kBの活性化にどのような因子が関与しているかというと、CARDをもったタンパク質が必須の役割を果たしているのです。CARDはアポトーシスに働く因子(カスパーゼなど)がもっていることを最初のほうでお話しましたが、CARDタンパク質はアポトーシス因子以外にもたくさんあるのです。ここでは、CARMA1やBcl-10 といったCARDタンパク質が働きます。
PKCはこのCARMA1をリン酸化し3量体を形成します。すると、別のCARDタンパク質Bcl-10が呼び寄せられ、自己多量体化します。これにより、MALT1ついでTRAF6が呼び寄せられ、NEMOのK63ユビキチン化を引き起こします。一方、TAK1が活性化されてIKKβのリン酸化が引き起こされ、両者によりNF-kBの活性化が誘導されます。
サイトカイン
サイトカインという言葉がたびたび出てきましたが、ここでまとめておきたいと思います。
サイトカインは活性化されたリンパ球、単球、マクロファージが産生するタンパクで、それに対するレセプターを持つ細胞のみに作用し、そのほかの細胞の増殖、機能発現、分化などを誘導します。
(種類、産生細胞、機能は多彩なので、一部を簡単に紹介しています)
種類 産生細胞 機能など IL-1 マクロファージ、樹上細胞、B、NK、好中球、血管細胞、繊維芽細胞 など T、B細胞の増殖、機能発現を助ける。NK細胞、マクロファージの機能増強。好中球の機能促進。炎症反応に関与。 IL-2 T、NK細胞 T細胞自身の増殖を誘導。B細胞の増殖と分化。NK細胞の増殖と活性増強。 IL-3 T細胞 GM-CSFやG-CSFともに好中球の、IL-4やM-CSFとともに単球系の、IL-4とともに肥満細胞系のそれぞれの未熟造血細胞の増殖を支持。 IL-4 T細胞 抗原と反応したB細胞の増殖。B細胞をIgG1、IgE産生細胞に分化。 IL-5 T細胞 抗原と反応したB細胞の増殖。B細胞をIgM、IgG、IgA 産生細胞に分化。 IL-6 T、B細胞、マクロファージ、繊維芽細胞 B細胞を抗体産生細胞に分化。肝に作用し急性期タンパクを産生。 IL-8 単球、繊維芽細胞、血管内皮細胞 好中球を遊走。 IL-10 Th2細胞、B細胞 T細胞からのIL-2、IFNγ産生、マクロファージからのIL-1、TNFαなどのサイトカイン合成を阻害する。 IL-13 T、NK細胞 B細胞の増殖、免疫グロブリンのクラススイッチを誘導。
好中球を遊走させるサイトカインにはIL-8の他、IL-8と同じく構造中に4つのシステインをもついくつかのサイトカインがあり、このような白血球走化性因子をケモカインと呼びます。ケモカインは微生物や異物の浸入部に好中球、マクロファージ、リンパ球などの白血球を呼び寄せて、炎症反応を起こします。
IL-8のように最初の2つのシステインの間に1個の他のアミノ酸が存在するC-X-Cサブファミリーと、MCP-1、MIP-1、RANTESなど介在アミノ酸がないC-Cサブファミリーがあります。前者は主に好中球を、後者は主にリンパ球、単球、好酸球などを遊走させます。
インターフェロンは抗ウイルス作用を持つタンパクでα、β、γの3種類があります。α、βをI型インターフェロン、γをII型インターフェロンといいます。αは好中球やマクロファージから、βは繊維芽細胞から、γはT細胞、NK細胞から産生されます。B細胞分化を促進したり、T細胞、NK細胞の細胞傷害活性を増強します。またインターフェロンγはマクロファージを活性化させ殺菌作用、抗腫瘍活性を誘導します。
自然免疫〜すばやい因子たち
それでは、獲得免疫より早い応答である自然免疫ではどのようなことが起こっているのでしょう?
体内に細菌が侵入したとき、除かれる方法として、この抗菌物質の分泌が体内でもあります。 炎症応答が起きると、細菌を殺すための細胞が細菌の侵入した組織に集まります。 好中球は第一の細胞です。この好中球はリゾチームのほか、ディフェンシンと呼ばれる抗菌分子群をもちます。 一方、炎症はまたβディフェンシンとい別のクラスのαディフェンシンに似た抗菌分子群も一部の組織で誘導します。ディフェンシンは細菌の膜を傷つけ、これを殺すことができます。
マクロファージや好中球はCレクチンレセプター(マンノースレセプター、βグルカンレセプター、スカベンジャーレセプター、補体レセプター)を介して組織内に浸入してきた病原微生物を認識します。これにより病原体を貪食したり、サイトカインを産生したりします。貪食された細菌は活性酸素やリソソームに貯蔵されていたリゾチーム、ラクトフェリンやデフェンシンなどの抗菌たんぱく質によって殺されます。(シグナル伝達についてはあとでお話します。)
また、マクロファージや樹上細胞などにはToll-like receptor(TLR)やNodファミリータンパク質が存在します。これらの受容体はそれぞれ違った病原体の分子パターンを認識してシグナルを誘導します。たとえば、グラム陰性菌が持っているLPSはTLR4によって認識されたり、ペプチドグリカンの関連分子はNod1,Nod2によって認識されます。これらによって病原体が認識されるとIL-1やIL-6、TNFα、ケモカインなど炎症性サイトカインの産生を誘導します。
さらに、これらマクロファージや樹上細胞は抗原提示細胞として働きます。
抗原提示細胞は、体内に侵入してきた細菌や、ウイルス感染細胞などの断片をタンパク抗原の取り込み、取り込んだタンパク抗原を分解・断片化してペプチドにします(プロセシング)。 抗原処理したペプチド断片をMHCクラスII分子と結合させ、自分の細胞表面に発現させ、 ヘルパーT細胞(CD4陽性T細胞)に抗原を認識させ、T細胞を活性化させます。つまり獲得免疫を誘導する働きもするのです。
また、食細胞による自然免疫と獲得免疫の橋渡しをする早期応答を早期誘導反応と呼んでいます。これにはナチュラルキラーNK細胞、γδ型T細胞、NKT細胞、CD5陽性B細胞などの因子が働いています。
NK細胞は抗原で感作されることなしに細胞傷害活性を持ちます。
補体
しかし、なんと言っても体内に侵入した細菌がすばやく除かれて炎症や障害が最小限に抑えられているのは、補体complementのおかげです。 補体は細菌の表面の物質を認識するものです。補体が細菌に結合すると、細菌の膜に穴があけられ細菌は殺されます。加えて、補体は好中球やマクロファージのような貪食細胞に細菌が飲み込まれるのを促進します。一旦、補体系が活性化されると、その一部の物質がさらに貪食細胞を呼び寄せ、これによって私たちの体にいる細菌たちはたとえ体に侵入しても大事に至らないようになっています。
補体のシグナル伝達
自然免疫から獲得免疫へ〜アジュバント活性
TLRとNodファミリーの詳しいお話に入る前に、少し追加しておきたいと思います。
自然免疫のお話と獲得免疫のお話を別々にしてきましたが、これまでにも少しふれたように、実際は自然免疫と獲得免疫は協調して働いています。
まずマクロファージ、樹状細胞は抗原提示細胞としても働き、T細胞に抗原を提示します。これによってT細胞が活性化し増殖します。このT細胞がB細胞を刺激し増殖成熟させ、抗体生成を行わせます。T細胞への抗原提示の段階で、抗原提示細胞からT細胞へは二つのシグナルが伝達されます。一つはT細胞受容体を介したシグナルでこれが抗原を提示し、抗原特異的なT細胞の活性化を促します。もう一つが補助刺激シグナルでこれは、抗原提示細胞が活性化していないと伝達されません。抗原提示細胞が活性化するためには、これらの細胞がタンパク質を異物として認識しなければなりません。生成されたタンパク質や生体内のタンパク質は基本的にはこれらの細胞には異物として認識されません。
抗原提示細胞を活性化するために同時にアジュバントを混ぜることによって、これらの細胞の活性化を促進し、かつ、抗原としてのタンパク質を異物として認識させることができます。アジュバントとはこういった免疫賦活作用のあるもののことを言います。結核菌やそのほかバクテリアの死骸をアジュバントとしてよく使います。
ワクチンや抗体を作製するときに、アジュバントを抗原とともに加えるのはこういった理由からです。
アジュバントを混ぜることによって抗原提示細胞の活性化を促しかつ、抗原としてのタンパク質を異物として認識させるわけです。これによって、T細胞へ二つのシグナルが伝達されT細胞が活性化し、そのT細胞によって刺激されたB細胞が活性化されて抗体産生が行われるわけです。
これからお話しするTLRやNodファミリーのリガンドはこういったアジュバント活性を持っていることが報告されてきています。
第三章 自然免疫とNodファミリー
ショウジョウバエの自然免疫〜TollとImd
ショウジョウバエの自然免疫のお話からしましょう。
ショウジョウバエにおける細菌感染の防御機構には2種類の経路があります。一つがTollの経路であり、真菌やグラム陽性菌の感染時に働きます。またImdの経路はグラム陰性菌やジアミノピメリン酸(DAP)型のペプチドグリカンをもつ細菌の感染に働きます。
Tollは細胞外にLRRをもち、細胞内に細胞内にTIR領域といわれるインターロイキン1レセプターの細胞内領域と似たような領域をもっています。その下流では、2つのアダプター分子dMyD88とtubeが存在し、いずれもデスドメインDDをもちます。次にDDとセリンスレオニンキナーゼ領域をもったPelleが結合し、最終的にNF-kB-Relファミリー因子であるDIFを活性化すると考えられています。DIFは通常アンキリンリピートをもったCactusという抑制因子と結合していて活性化しないようになっていますが、シグナルが来てCactusが分解してDIFが自由になると活性化して抗真菌ペプチド遺伝子の転写を誘導します。
グラム陽性菌の感染はペプチドグリカン認識タンパク(PGRP)ファミリーのうちPGRP-SA/GNBP-1という複合体が認識してTollを活性化します。このとき、Spaetzleという因子が活性化されることがTollの経路に重要です。Spaetzleはプロテアーゼで切断されて活性化し、Tollを活性化すると考えられています。
一方はImdの経路を活性化します。ImdはTNFαの下流で働くRIPと構造的に似た因子です。ImdにはFADDが結合し、その下流でMAP3キナーゼの一つであるTAK1が働いて、IKKβ、IKKγの活性化を誘導すると考えられています。また、DREDDとよばれるヒトのカスパセ−ゼ8と似た因子もFADDの下流で働くことが活性化に重要であると言われています。その結果、Imdの経路ではNF-kB-RelファミリーのRelishを活性化します。Relishはそれ自身がアンキリンリピートを持っていて活性を抑制しており、この領域が切断されることで活性化が誘導されます。
Imdの経路はPGRPファミリーのうちPGRP-LCとPGRP-LEが細菌を認識して活性化すると考えられています。
細胞表面で病原体から守るTLR
話をヒトの自然免疫に戻します。
これまでのお話でも出てきたように、TLRやNodファミリーはヒトにおいて自然免疫に関与しています。Nodファミリーについては3章で詳しくお話します。ここではTLRについてお話します。
TLRはショウジョウバエで見つかったTollと似た因子で、細胞膜に存在します。細胞外にLRR、細胞内にTIR領域をもっています。現在までに11種類のTLR(TLR1〜TLR11)が報告されていてファミリーを形成しています。TLRはそれぞれが異なった病原体成分に対する反応に関わっています。
TLR2&TLR1(ヘテロ2量体) ペプチドグリカン細菌由来のリポタンパク質 TLR2&TLR6(ヘテロ2量体) マイコプラズマ由来のリポタンパク質 TLR3 2本鎖RNA (ウイルス) TLR4&MD2(ヘテロ2量体) LPS(細菌の構成成分) TLR5 細菌のフラジェリン (鞭毛タンパク質) TLR7 イミダゾキノリン (合成化合物),(マウスでは)1本鎖RNA(ウイルス) TLR8 イミダゾキノリン (合成化合物),(ヒトでは)1本鎖RNA(ウイルス) TLR9 CpG DNA (細菌由来のDNA)
TLRの下流ではTIRドメインを持った様々なアダプター分子が結合してシグナルを伝えています。
MyD88はTIRドメインをもったアダプター分子でTIRドメインを介してTLRに結合します。TLRが病原体をLRRを介して認識すると、MyD88を介してIRAK、TRAF6を活性化しNF-kBを活性化します。その結果TNFaやIL-1、IL-6といった炎症性サイトカインの産生が誘導されます。
しかし、MyD88によらないNF-kB活性化経路もあることがわかってきています。TRAM、TRIFを介する系です。TRIFはTRAF6を介してNF-kBを活性化するだけでなく、TRAF3、TBK1/IKKiを介してIRF3の活性化と続くI型インターフェロンの産生を誘導します。
またTLR7、8、9の下流ではMyD88依存的にIRF7が活性化され、I型インターフェロンの産生が誘導されます。
このようにして、TLR刺激により炎症性サイトカインの産生が誘導されて好中球やマクロファージなど炎症細胞の浸潤がおきて一連の炎症反応が起こります。また、インターフェロンは抗ウイルス作用をもつ遺伝子の発現を増強してウイルスに対する生体防御機構を活性化します。
自然免疫の活性化に引き続き獲得免疫を誘導します。
TLR刺激は抗原特異的T細胞の増殖を誘導します。また、T細胞の分化も制御しています。T細胞は1型ヘルパーT細胞(Th1)と2型ヘルパーT細胞(Th2)へ分化しますが、Th1はIFN-rを産生し、主に細菌やウイルスに対する免疫に、Th2はIL-4を産生し、アレルギーに対する免疫に関与します。TLRのシグナルはIL-12やIL-18などのサイトカインを産生して、Th1への分化を誘導します。
こうして、TLRのシグナルは獲得免疫の活性化を量的にも質的にも制御しているのです。
Dectin-1のシグナル伝達〜CARD9
Cレクチンレセプターのお話です。
先にお話したように、組織内に浸入してきた病原微生物に対して、Cレクチンレセプターは貪食したり、サイトカインを産生し、早期の免疫応答に関与しています。
C-レクチンレセプターのひとつであるDectin-1は、マクロファー ジや樹上細胞、好中球などに発現していて、βグルカンを認識していることがわかっています。また、どのようにシグナルが伝えられているか、その分子メカニズムもわかってきました。
Dectin-1は細胞外にC-レクチン様ドメイン、細胞内にITAMモチーフを持っています。リガンドを認識するとITAMにSykタンパク質が結合し、CARD9が呼び寄せられます。このCARD9によってBcl-10が活性化され、MALTが活性化されます。この経路は先に説明したTCRやBCRの経路と似ていますね。こうしてIKKが活性化され、NF-kBの活性化が誘導されます。
Apaf-1〜カスパーゼ調節因子
さて、Nodのお話に入りましょう。
最初に紹介したアポトーシス調節因子Apaf-1と構造が似ている因子が最近次々と見つかってきました。これらの因子は中央にヌクレオチド結合性多量体領域(NOD)をもっているので、これらを総称してNodファミリー、NLRファミリー(Nucleotide-binding domain and leucine rich repeat ; NLR)と呼んでいます。Apaf-1はカスパーゼ9を活性化してアポトーシスのみをを誘導するのに対してこのファミリーの因子の中にはNF−kBの活性化を誘導するものがあることがわかってきています。
その前に、Apaf-1について詳しく説明しておきます。
Apaf-1はカスパーゼ9の調節因子です。Apaf-1はCARD領域のほかにヌクレオチド結合性多量体領域(NOD)とWD40リピート領域をもっています。アポトーシスを起こすようなシグナルがくるとミトコンドリアからチトクロムCが流出します。Apaf-1のWD40リピートはチトクロムCのセンサーとして働き、チトクロムCがWD40リピートに結合するとApaf-1はNODを介して多量体化します。これによってApaf-1のCARDに結合したカスパーゼ9はお互い近くに集められて活性化するのです。このApaf-1の多量体化にはATPまたはdATPを必要とします。
WD40リピートをもたないApaf-1はチトクロムCやATPによらず常に多量体を形成して活性化します。WD40リピートは通常、多量体化を抑制していてシグナルがきたときだけ活性化できるようになっているのです。
Apaf-1の仲間たち〜Nodファミリー
Nodファミリータンパク質はヒトでは機能がわかっていないものを含めて約20種類存在します。これらの因子はNODのほかに、下流にシグナルを伝達するエフェクタードメインとして働くCARDやPyrinドメインなどをN末にもち、上流の因子に対するセンサーとして働くロイシンリッチリピート(LRR)をC末にもっています。Apaf-1はC末のWD40リピートがチトクロムCを認識し、NODを介してApaf-1が重合体化してカスパーゼ9を活性化しますが、LRRをもつNodファミリーは細菌の構成成分を認識してNODが重合体化し、下流の因子を活性化すると考えられています。
最近、Nodファミリーの名前がHugoによって正式につけられました。下の図はまだ旧名のままです。新たな名前は「その他のNodファミリー」の項にある表を見てください。
植物にも同じ仲間が?
植物にもNodファミリーと同じような構造をしたものが存在します。
植物の細胞の表面と内部にはR因子というものがあって、どちらもLRRをもち病原体を認識しています。細胞の内部に存在する細胞質性R因子はNodファミリーと同じような構造をしていてLRRのほかにエフェクタードメインとNODをもっています。細胞表面に存在する細胞膜性Rは細胞膜を貫通していて細胞の外側にLRR、内側にエフェクタードメインを持っています。細胞膜性R因子に似たような因子もヒトに存在します。これらはToll様受容体(Toll like receptor; TLR)と呼ばれていて、病原体を認識します。(自然免疫のところで少し話をした因子です。)
こうしてみると、動物と植物で似たような生体防御機構をもっていることがわかります。
Nod1とNod2の機能
Nodファミリーは細胞内に存在する、TLRと同じように免疫に関与する因子であると考えられます。
Nodファミリーの中でもNod1およびNod2は早く発見され多くの研究がされてきました。
Apaf1がC末端側のWD40リピートでチトクロムCを認識するのに対し、Nod1、Nod2のLRRはペプチドグリカンの構造でみられるiE-DAP、MDP構造にそれぞれ応答します。リガンドについては次に詳しくお話します。
Nod1やNod2はこれらの細菌成分を認識して重合体化します。Nod1,2はN末端側にCARDを1つまたは2つもっていて、このCARD領域は下流の因子であるRICKというキナーゼのCARD領域に結合し活性化します。RICKはIKK複合体を活性化し、NF-kBの活性化を誘導します。NF-kBの活性化は炎症性サイトカイン、ケモカインなど免疫に関する因子の発現を誘導して生体防御反応を示します。
このようにして起こるCXCLケモカインの分泌は、細菌キラーである好中球の刺激部位への呼び寄せを引き起こします。このことから、Nod1,Nod2は感染部位への好中球の呼び寄せを介して細菌に対する自然免疫に関わっているといえます。また、Nod1,Nod2刺激化合物は免疫活性化アジュバンドとして、抗体生産やIV型アレルギー応答(遅延性過敏感応答)を促進することが知られています。
こうしてNod1、Nod2はTLR同様、自然免疫および獲得免疫にかかわっているのです。
さらに、TLR刺激性細菌成分とNod刺激性細菌成分を同時に加えると、相乗的なサイトカインの生産が認められるなど、NodとTLRは免疫応答において協調的に働いているとかんがえられます。
Nod1とNod2の刺激物質
先にNod1、Nod2はペプチドグリカンの中にある構造に応答するとお話しました。これがペプチドグリカンの構造、そしてMDP、iE-DAPはその一部の構造です。MDP構造はすべての細菌に、iE-DAP構造はグラム陰性菌と一部のグラム陽性菌にあります。
Nod1、Nod2の刺激物質はiE-DAP、MDPだという誤認が多いですが、これらは合成リガンドであって、生理的なものではありません。
ペプチドグリカンの構造とNod1、Nod2刺激物質のコア構造
まず、細菌の中ではMDPそのものは存在しませんし、iE-DAPもほとんど存在しません。また、ペプチドグリカンそのものはNod1,Nod2によって認識できません。
それでは私たちの体の中ではNod1,Nod2はいったい何に応答しているのでしょうか?
細菌にはペプチドグリカンを合成・回収する経路があります。その過程ではiE-DAPやMDP構造を含んだ小分子群が作られています。
これらの小分子のうちいくつかがNod1、Nod2によって認識されることが報告されています。GlcNAc-MurNAc-ペプチド,GlcNAc-anhMurNAc-ペプチド、 トリペプチドなどがそうです。しかし、今のところ、どの分子が細菌内に多く存在して、かつ、強い刺激活性があるのかわかっていません。未知の合成経路でつくられる、未知の因子がNod1,Nod2の刺激物質である可能性もあります。
Nod1、Nod2と細菌たちの戦い
Nod1、Nod2はどのような細菌に対して働いているのでしょうか?
Nod1はiE-DAPを含む小分子群、Nod2はMDPを含む小分子群を認識し、それらはグラム陰性菌と一部のグラム陽性菌に、Nod2のリガンドはすべての細菌にあるとお話しました。それならば、それらの細菌に対して同じように応答するかと考えられますが、どうやら違うようです。これらの小分子群を持っている細菌でもNod1,Nod2 に強く応答する細菌がいればほとんどしない細菌もいます。例えば、バチラス属はNod1の刺激活性を強く持っていますが、同じiE-DAPタイプをもつラクトバチラス属やバクテロイド属には弱い刺激活性しかありません。
欠損マウスの解析からは、Nod1はピロリ菌や、緑膿菌に対する応答性に関わることが報告されています。また、過剰発現やsiRNAのノックダウンによる解析からはリステリアや、大腸菌、赤痢菌などによるNF-kBの活性化やサイトカインの産生にかかわっていると報告されています。一方、Nod2はリステリアに対する腸内免疫防御に関わることが示唆されています。
しかしながら、これらの報告に対する反論も多く、また私たちの研究でもこれらを支持する結果は得られていません。
いったい、どの細菌が本当にNod1、Nod2によって認識されているのか、、、更なる研究が必要そうです。
しかしながら、これらのことが本当だとすると、Nod1、Nod2は細胞内に存在するタンパク質であるのに、緑膿菌、バチラス属など、細菌内病原細菌でない細菌にも応答しているといえます。実際、私たちは細菌の菌体そのものより培養液中に多くのNod1刺激分子を含んでいることを明らかにしており、これらの細菌はNod1刺激活性の強い物質を菌体外に放出して、Nod1はこれを感受すると考えられます。また、細胞外のiE-DAPやMDPといった化合物もNod1,Nod2依存性の免疫応答を引き起こすことから、Nod1,Nod2は単に細菌内病原細菌の受容体ではなく、細菌に対する一般のセンサーとして機能すると考えられます。
ちょこっとコラム〜Nod1,Nod2はどうやってリガンドを認識するの?
これまでにNod1、Nod2 が直接これらのiE-DAPやMDPと結合することを証明した論文はありません。ひょっとしたら、他の未知の因子がこれらのリガンドを認識していて、Nod1、Nod2はメディエータということもありうるかもしれません。また、直接認識するとした場合、細胞内にあるNod1,Nod2がどうやって細胞外のリガンドを認識するのかよくわかっていません。MDPについてはpepT1というトランスポーターを介して細胞内へ輸送されるという話がありますが、本当であるかは疑問があり、これらのことはまだまだ研究の余地がありそうです。
Nod1、Nod2の働いている場所
Nod1、Nod2はどんな組織にあるのでしょうか?
組織のマイクロアレイのデーターベースをみると、Nod1はいろいろな組織に発現しているのに対し、Nod2はマクロファージといった抗原提示細胞(APC)に特異的に発現しています。Toll-likeレセプター(TLR)もAPCに発現しています。Nod1の発現についてさらによくみると、上皮細胞で発現しています。
APCなどの免疫細胞が病原体の認識に重要であることは、免疫のところでもお話したように、よく知られていますが、上皮細胞のような非免疫細胞はどのように重要なのでしょうか。
上皮細胞をとってきて培養し、Nod1の刺激物質で処理してやるとサイトカインやケモカインなどの産生が誘導されます。また、Nod1の刺激物質を投与したマウスから上皮細胞を取って調べると、やはりケモカインの発現が見られます。
上皮細胞は免疫細胞と違って貪食をしません。ではどうやってNod1は病原体を認識するのでしょうか。このことは、ちょうど先の項でお話したように、Nod1は細菌そのものではなく細菌外に放出された刺激物質を認識すると考えると納得がいきます。
さらにNod1は特に、肺(peribranchial area)で高い発現をしていることがわかりました。実際、Nod1の刺激物質をマウスに投与すると、腹腔に入れた場合や口から飲ませた場合に比べて、鼻から吸わせた場合に高いケモカイン産生が見られます。
Nod1が肺で働いていることは、後で述べる病気とかかわりがありそうです。
Nod1、Nod2のシグナル伝達
Nod1、Nod2がこのような細菌の成分を認識すると、どのようにNF-kBの活性化を誘導するのでしょうか?
Nodファミリーのイントロでお話ししたように、NodファミリーはNODを介して重合体化します。この重合体化により下流の因子が結合して活性化されます。
Nod1、Nod2はこの重合体化により下流因子であるRICKがCARDを介して結合します。これによりRICKは近接化し、ユビキチン化されます。このユビキチン化は63番目のリジンを介して連結されています。
(ユビキチン化についてのお話は最初の方で詳しくお話ししました。)
このRICKのユビキチン化を介して、TAK1複合体が結合して、IKKβのリン酸化を誘導します。これによりIkBが分解されて、NF-kBが核へ移行できるようになり、炎症系シグナル分子に関する遺伝子の発現が誘導されます。
またNEMO(IKKγ)もユビキチン化され、これがNF-kBの活性化に重要であるとも言われています。
一方、脱ユビキチン化酵素A20が、RICKの脱ユビキチン化を誘導してNF-kBの活性化が抑制します。
A20はNod1、Nod2によるNF-kB活性化によって誘導されます。つまり、Nod1、Nod2によるNF-kB活性化においてネガティブフィードバックとして働いていると考えられます。
NodファミリーとASC 〜cryopyrinとIpaf
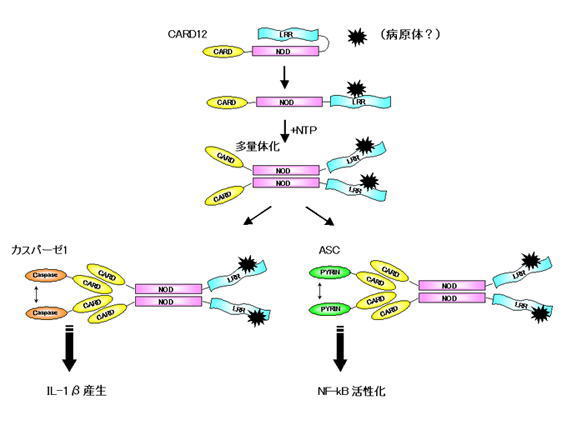
一方、NLRC4(CARD12/Ipaf)はNod1やNod2と同様にエフェクタードメインとしてCARDをもちますが、RICKを活性化することができません。調べてみるとNLRC4/IpafがNF-kBを活性化するにはASCという分子が必要であることがわかってきました。
ASCはN末にPyrin様領域、C末にCARD領域をもったアダプター分子です。Pyrin様領域とは家族性地中海熱という炎症疾患の原因遺伝子であるPyrinと似たようなアミノ酸配列をもった領域をいいます。ASCを細胞にたくさんつくらせてやると、NF-kBの活性化やIL-1βの産生を誘導します。いくつかのNodファミリーと一緒に細胞に入れてやると少しのASCでもNF-kBの活性化やIL-1βの産生を誘導できるようになります。これはNodファミリー因子がASCの重合体化を促進、つまりNodファミリータンパク質によってASC同士が近くに集められて活性化できるようになるのです。
NLRC4/IpafのCARDはASCのCARDに結合します。これによってASCがお互いが近くに集められて活性化します。
一方、NLRC4/Ipafはカスパーゼ1の活性化をします。最初のほうでお話したように、カスパーゼ1はN末にCARDをもった上流カスパーゼで重合体化することで自己活性化します。NLRC4/IpafのCARD領域はカスパーゼ1のCARD領域に結合して活性化します。カスパーゼ1は主に炎症性サイトカインであるIL-1β、IL-18の産生に関与していて、活性化したカスパーゼ1はIL-1β、IL-18の活性抑制ドメインを切断することで活性型に変換します。
ASCやNLRC4/Ipafを欠損したマクロファージはサルモネラ菌に応答したカスパーゼ1の活性化およびIL-1βの産生が起こらなくなることがわかりました。
さらに、最近、NLRC4/IpafはTLR5リガンドでもある細菌鞭毛タンパク質フラジェリンによるIL-1β分泌に必須の役割を果たしていることが報告されました。腸のような常在細菌を持つ器官などではTLRリガンドに対する脱感作が認められますが、NLRC4/IpafのIL-1β分泌は、こうした脱感作器官でも病原細菌の侵入によりIL-1β依存性の炎症応答を起こせそうです。
一方、TLR5を欠くマウスのマクロファージではこれらのリガンド分子刺激によるNF-kB,p38の活性化は起こらないのに対して、NLRC4/Ipafを欠損したマウスでは正常であることから、TNFα,IL-6などの産生はTLR5依存性であることが示唆されています。
Nodファミリーの仲間にはエフェクタードメインとしてPyrin様領域をもったものが多く存在します。Pyrin領域をもつNodファミリーのうちNLRP3(cryopyrin)、NLRP6(PYPAF5)、NLRP12(PYPAF7)もASCを介してNF-kBの活性化やIL-1βの産生を誘導します。PYPAFのPyrin様領域がASCのPyrin様領域と結合して活性化します。そして、ASCのCARD領域を介してカスパーゼ1のCARD領域と結合し、カスパーゼ1の活性化を誘導すると考えられます。
NLRP3/cryopyrinは細菌のRNAに応答して活性化しカスパーゼ1を介してIL-1β、IL-18の産生を誘導することが示されました。NLRP3/cryopyrinやASCを欠損したマウスはRNA刺激してもIL-1β、IL-18の産生が誘導されません。NLRP3/cryopyrinの認識するリガンドの最少構造はモノヌクレオチド様であるらしく、NLRP3/cryopyrinはモノヌクレオチド類似の合成化合物であるR837,R878に応答します。これらの化合物はTLR7のリガンドでもあります。
一方、NF-kB活性化によるTNFαやIL-6などの産生は正常であると報告されました。
また、NLRP3/cryopyrinは痛風にかかわる尿酸結晶に応答するという報告や、TLR活性化因子+ATP応答してP2X7受容体の下流でカスパーゼ1を活性化するという報告が別々のグループからされています。
家族性地中海熱の原因遺伝子であるPyrinはASCのPyrin様領域に結合します。するとASCがPYPAFのPyrin様領域に結合できなくなります。Pyrin遺伝子に変異を持ったマウスでは、過剰なIL-1β産生が誘導されることが報告されています。このように、PyrinはPYPAFによるNF-kBやIL-1βの活性化を抑制する因子であるといえます。
ちょこっとコラム〜NF-kBの活性化には関係しないの?
TLR5、TLR7を欠くマウスのマクロファージではこれらのリガンド分子刺激によるNF-kB,p38の活性化は起こらないのに対して、NLRC4/IpafやNLRP3/cryopyrinを欠損したマウスでは正常であることから、TNFα,IL-6などの産生はTLR5、TLR7依存性であることが示唆されています。従って、NLRC4/IpafやNLRP3/cryopyrinはIL-1βの分泌、caspase-1の活性化のみに関わっているように見えます。これは先に話した過剰発現系の結果とは一致しないように見えますね。やはり過剰発現系の実験はおかしなことを反映しているのでしょうか?それとも人とマウスの違いや、TLRとの重複性などが考えられるかもしれませんね。
インフラマソーム
ASCはがん抑制遺伝子?〜アポトーシスとの関係
ASCについて少し違った方面からの研究も進んでいます。
ASCはapoptosis-associated speck-like protein containing CARDの略で、名前のとおりもともとは抗癌剤処理によって癌細胞にアポトーシスを誘導したときに細胞内で凝集するCARDタンパクとして発見されました。スペックとはタンパクの凝集塊のことで、ASCを細胞にたくさん発現させるとASCのスペックが免疫染色で観察できます。
ASCを細胞にたくさん作らせてやったり、NLRC4/IpafなどのNodタンパク質で重合体化させてやるとアポトーシスを誘導します。
このASCを介したアポトーシスはカスパーゼ8を介しているという報告とカスパーゼ9を介しているという報告があります。私たちはASCがカスパーゼ8を活性化し、細胞によってはBidを切断、活性化してミトコンドリア経路を介してカスパーゼ9を活性化していることを示しました。
ASCはp53によって発現が誘導されるという報告もあり、紫外線や化学物質によるアポトーシスにASCが関与していることも示唆されています。NLRC4/Ipaf もp53で誘導されるという報告があります。
また、ASCは target of methlation-associated silencing-1(略してTMS1)ともよばれていて、つまり、ASCはDNAメチル化によって発現が抑制される分子です。
一般的に、プロモーター領域のCpGアイランドがメチル化するとヒストンのアセチル化が亢進して転写が抑制されると言われています。正常細胞ではCpGアイランドはメチル化されていませんが、多くの癌でがん抑制遺伝子などの遺伝子がメチル化されていてこれらの遺伝子の機能が抑制されています。
ASC遺伝子も乳癌や大腸癌などの多くの癌細胞でメチル化が起こっていてASCの発現が抑制されていることが報告されてきています。このようなことから考えると、ASCは癌との関連性も示唆されそうです。
その他のNodファミリー 〜NALP-1、CIITA,、NAIP
NLRP1(NALP1/CARD7)はN末にPyrin様領域をもつ他にC末に不完全長のPyrin様領域とCARDという複雑な構造をとる因子ですが、これもASCを介したカスパーゼ1の活性化によりIL-1βの産生を誘導するといわれています。最近、マウスのNALP1オーソログの1つNLRP1bが、炭疽菌の致死因子に対する感受性を決定することが報告されました。炭疽菌致死因子によるマクロファージ内のcaspase-1の活性化と細胞死にNALP1bが必須の役割を果たしているようです。
N末のエフェクタードメインにCARDやPyrin様領域をもたないNodファミリーもあります。
CIITAはエフェクタードメインにactivation domain (AD) をもつNodファミリータンパク質です。NODとLRRをもち、Nod1やApaf-1などと同様にNODを介して自己重合体化して活性化します。CIITAはMHCクラスIIの転写を活性化します。Nod1、Nod2とは違ってNF-kBは活性化しません。樹状細胞のCIITAはN末のADに加えてCARD領域をもちます。このCIITAはCARDをもたないものより強くMHC-IIのプロモーターを活性化できます。CIITAのCARDと結合する因子LRRが応答する病原体はまだわかっていません。
NAIPもNODとLRRをもつマクロファージ特異的Nodファミリータンパク質でエフェクタードメインにbaculovirus IAP repeat (BIR) ドメインをもちます。細胞内病原細菌であるレジオネラのマウス感受性遺伝子座がNAIPオーソログの1つNAIP5と同一であることが示され、他のNodタンパク質同様、細菌に対する免疫応答に関わることが明らかになりました。レジオネラの細胞内増殖抑制にはcaspase-1の活性化が必要ですが、IL-1βの活性化は必要でないことがわかり、NAIPはcaspase1の活性化を介して、IL-1βとは異なるタンパク質のプロセシングを介してレジオネラの細胞内増殖を抑制するものと考えられています。
これまでにお話した以外のNodタンパク質はほとんど機能がわかっていません。
いくつかのNodタンパク質については炎症系免疫応答を阻害すると報告されています。たとえば、NLRP10(PYNOD)はLRRを持っておらず、ASC情報伝達系を阻害といわれています。また、NLRC3(Nod2),NLRP14(Nod3)の選択的スプライシングフォームもNF-kB活性化経路を阻害するといわれています。NLRP2(Pypaf2),NLRP7(Pypaf3)もASC情報伝達系を阻害すると報告されています。
しかし、これらはタンパク質を過剰発現させた結果であるため、今後、欠損マウス等の解析をしていく必要がありそうです。
また、NLRP5(Mater)は卵細胞で存在し、その欠損マウスは2胚葉期で死亡しますが、その分子学的機能は不明のままです。
これまでお話してきたNodファミリー(NLRファミリー)と関連因子についてまとめてみました。
name other name Locus Expression Downstream effectors Function Memo Apaf1 12p23 ubiquitous caspase-9 induce apoptosis Ligand: cytochrome C Nod1 CARD4 7p14 epithelium,( heart, skeletal muscle, spleen, overy) RICK, caspase-9 activate NF-kB
enhance apoptosisLigand: iE-DAP
inducible by IFNγNod2 CARD15 16q12 monocytes, dendreitic cells, granulocytes RICK activate NF-kB
enhance apoptosisLigand: MDP
inducible by LPS, TNFNLRC3 NOD3 16p13 NLRC4 IPAF, CARD12, CLAN,CLR2.1 2p22 bone marrow, monocytes,(colon, kidney, liver, placenta, lung) ASC, caspase-1 activate NF-kB
enhance apoptosis
activate caspase-1Ligand: flagellin
IL-1β secretionNLRC5 NOD27 16q13 NLRX1 NOD9 11q23 NLRP1 DEFCAP, NAC, CARD7,CLR17.1 17p13 PBL, heart, thymus, spleen, kidney, liver lung caspase-1,5, ASC activate caspase-1 NLRP2 PYPAF2,NBS1, PAN1, CLR19.9 12q13 NLRP3 PYPAF1,Cryopyrin, CLR1.1, NALP3 1q44 PBL, (chondrocytes) ASC, caspase-1 activate NF-kB
enhance apoptosis
activate caspase-1Ligand: bacterialRNA
IL-1β secretionNLRP4 PYPAF4, PAN2, RNH2, CLR19.5 13q13 spleen, (kidney, liver, lung, placenta, thymus) IKKa? inhibit NF-kB activation NLRP5 PYPAF8, MATER, PAN11, CLR19.8 19q13 oocytes NLRP6 PYPAF5, PAN3, CLR11.4 11p15 epithelium, granulocytes, monocyte ASC activate NF-kB
enhance apoptosis
activate caspase-1IL-1β secretion NLRP7 PYPAF3, NOD12, PAN7, CLR19.4 19q3 NLRP8 PAN4, NOD16, CLR19.2 19q13 NLRP9 NOD6, PAN12, CLR19.1 19q13 NLRP10 PAN5, NOD8, Pynod, CLR11.1 11p15 heart, skeletal muscle, brain ASC? inhibit ASC-mediated NF-kB activation and apoptosis? lacks LRRs NLRP11 PYPAF6, NOD17, PAN10, CLR19.6 19q13 NLRP12 PYPAF7, Monarch1, RNO2; PAN6, CLR19.3 13q13 granulocyte, macrophages, eosinophils ASC activate NF-kB
enhance apoptosis
activate caspase-1IL-1β secretion NLRP13 NOD14, PAN13, CLR19.7 19q13 NLRP14 NOD5, PAN8, CLR11.2 11p15 NAIP 5q13 macrophages, brain, lung, spleen, liver TAK1 inhibit caspase inhibit apoptosis
resistance to Legionella pneumophila?CIITA 16p13 B cells, dendreitic cells, lymphocytes, thymic epithelium RFX5, CBF, NF-Y MHC-II coactivator inducible by IFNγ ASC 16p11 PBL, leukocytes, colon, thymus, spleen, small intestine caspase-1,8 activate NF-kB
enhance apoptosis
activate casapse-1adaptor of PYPAF1,5,7 POP1 16p11 heart, liver, skeletal muscle, brain ASC, IKK? inhibit NF-kB activation? PYRIN 16p13 neutrophils, eosinophiles, monocytes ASC inhibits PYPAF1- and CARD12-mediated NF-kB activation negative regulator of pypaf1
inducible by IFNγ,LPS
*論文をもとにまとめましたが、まだ機能が確かでないと思われるものもあります。
細胞内で働く新たな因子〜RIG
Nodファミリーのように細胞内で病原体を認識する新たな因子群が見つかってきました。
先に、ウイルスの二本鎖RNAはTLR3によって1型インターフェロンを産生するとお話しました。しかし実際、ウイルスに感染した細胞はほとんどがTLR3に依存せずインターフェロンの産生をします。また、一本鎖RNAはTLR7、ウイルスDNAはTLR9によって認識されてインターフェロンを産生しますが、これらが発現していない細胞(cDC)でもウイルスによるインターフェロン産生が誘導されることがわかっていました。
近年、遺伝子クローニングによる解析で、RIG-Iという細胞内因子がウイルスの二本鎖RNAに応答してインターフェロンを産生することがわかりました。RIG-IはCARD領域を2つとDExD/Hヘリカーゼ領域をもった因子です。さらにRIG-Iと構造的に似た因子としてMDA-5が見つかりました。この因子も二本鎖RNAに応答してインターフェロンの産生を誘導しますが、RIG-IとMDA5は違った種類のウイルスを認識するようです。
RIG-Iのヘリカーゼ領域と似ているLGP2はCARD領域を持っておらず、RIG-I/MDA-5のシグナル伝達の抑制因子であると考えられています。
pDCでは主にTLR7、9がウイルス応答に関与していますが、cDCではRIG-I/MDA-5が関与しているようです。
RIG-I/MDA-5のシグナル伝達のアダプター分子として、IPS-1(MAVS/VISA/CARDIF)が同定されました。IPS-1はN末側にRIG-IやMDA5と似たCARD領域を持っていてCARD領域を介して結合して活性化します。この因子はおもしろいことにミトコンドリアの膜に存在しています。
IPS-1の下流ではTBKとIKK-iが活性化されて、IRF-3、IRF-7がリン酸化されます。
以前に、FADDやRIPが二本鎖RNAによるインターフェロン産生に必要であることが、ノックアウト細胞を使った実験で示されていましたが、FADDやPIPもIPS-1に結合してNF-kBの活性化を促進するようです。しかし、ウイルス感染時のインターフェロン産生は影響を受けないと報告されており、これらの因子の関与については更なる解析が必要そうです。
また、TLR9で認識されるようなウイルスや細菌のDNAもまた細胞内の別の因子によって認識されてインターフェロンを産生することが報告されました。このシグナル伝達もまた、IPS-1が関与しているという意見がありますが明らかでありません。
最近、DAIと呼ばれる因子が細胞内のdsDNAを認識するセンサーであることが報告されました。DAIがどのようなシグナル伝達を介してインターフェロンを産生しているのか、興味があるところです。
認識から逃れる細菌たち
細菌も私たちの体の攻撃に対して無防備というわけではありません。特に、私たちの体の中に住んでいる細菌は「自分の外側が認識されて攻撃されやすい」という弱点を克服する手段をとっています。1つは、莢膜capsuleを細胞の外に作る方法です。 つまり、補体や抗体が細菌本体に付かないようにする。LPSの認識ができないようするなどです。鞘の主要成分もLPS同様に多糖のものが多いです。 たとえばエンテロバクテリア属の細菌、大腸菌はLPSに加えて莢膜多糖を外膜から突き出す形で体を保護しています。これによって細菌はある程度、私たちの免疫応答から自分自身を防ぐことができます。エンテロバクテリア属の莢膜多糖も株により形が違います(Kセロタイプ)。
他にも、私たちの体から認識されない方法を細菌は持っています。 1つは、先にあげた細菌が持つ炎症を引き起こす物質の形を変えて隠れる方法です。 「Nod1,Nod2と細菌の戦い」のところで刺激活性の図を示しましたが、同じようにLPSを持つ細菌でもTLR4活性が違いますし、ある種の細菌のペプチドグリカン関連分子はNod1をよく活性化しません。
私たちの体はTLR4/MD2を介してLPSを認識し炎症応答を起こしますが、その認識される部分、LipidAの部分が変わると認識されにくくなります。バクテロイデス門BacteridetesやHelicobacter pyloriのLPSはTLR4/MD2が認識するのに必要なLipid Aの部分の2つのリン酸のうちの1つがないために、生理的にはほとんどTLR4を活性化しません。 また、Lipid Aの脂肪酸の大きさ、Lipid Aにある脂肪酸の数も刺激活性に大きく影響を与えます。大腸菌などではアシル基が6本の脂肪酸で炎症性が高いのですが、H. pyloriは3,4本しか脂肪酸がついておらず、上記のリン酸がない問題と合わせて生理的条件にはTLR4を刺激しえません。病原菌であるネズミチフス菌Salmonella enterica enterica serovar Typhimuriumなんかは、脂肪酸の足の数を感染時、変えてしまいます。ヒト髄膜炎の病原菌Neisseria meningitidisの炎症を起こしにくい株は、脂肪酸5本足で、TLR4/ヒトのMD2をほとんど活性化しません。他にも、緑膿菌Pseudomonas aeruginosaやその仲間はTLR4刺激活性を持っていませんが、5本足です。野兎病の病原菌の仲間Francisellaもリン酸1つで、4本足。
LPSとTLR4/MD2と同様に、ある種の細菌のペプチドグリカン関連小分子はNOD1を活性化しません。 グラム陽性菌のうち、乳酸菌目LactobacillalesはNOD1刺激活性に必要なコアiE-DAPのDAPの部分がLysとなっていて、NOD1を活性化できません。ヒトの腸に大量にいるFusobacterium類はLan(ランチオニン)になっていて、NOD1はあまり効率よく認識できません。 環境細菌Spirochaeta stenostreptaはDAPの部分がオルニチンになっていますし、構造異性体のLL-DAPを持つ土壌細菌Arthrobacter tumescensもNOD1が認識出ません。さらに環境細菌の多いBacillus属の一部の細菌はiE-DAPをアミド化した物質を作り、NOD1刺激性を弱めると言われています。
| 第五章 病気から見たNodファミリー |
Nodファミリーと病気の関連性
いくつかのNodファミリー遺伝子の変異が炎症性疾患とかかわっているということがわかっています。
Nod2のLRRの変異はクローン病といわれる炎症性腸疾患と関連しています。これについては後で詳しくお話します。
Nod2のLRRを部分的に欠いた変異体では病原体に応答したNF-kBの活性化を誘導できません。また、Nod2のNODに変異があると恒常活性化や過敏感反応を示し、Blau病や若年発症性サルコイドーシス(EOS)という炎症性免疫疾患を引き起こします。
その他、骨髄移植をNod2遺伝子の変異を持つドナーとレシピエントの間で行うと、拒絶反応(移植片対宿主病;GVHD)の危険性が高くなると報告されています。
Nod1の変異もNod2と同様クローン病の罹患率を上げることが知られています。また、アレルギー性喘息のリスクを上昇させることもわかってきています。アレルギー疾患については次で詳しくお話します。
いずれにしても、これらの因子に変異があっても必ずしも病気になるわけではなく、病気になるリスクが上昇するということです。つまりNodの変異だけで病気を決定づけられません。また、病原体などの環境因子のみでも決定されません。これは、Nodファミリー因子が病原体の認識にかかわっていて、Nodの変異と環境因子とが複雑に関わっているということです。
NLRP3/cryopyrinのNODの変異は全身性炎症性疾患である家族性寒冷蕁麻疹(CINCA)やMuckle-Wells症候(MWS)、慢性神経皮膚関節症(FCAS)を引き起こす原因になります。この変異をもったNLRP3/cryopyrinは恒常活性型になり、常にASCと結合してNF-kBの活性化やIL-1βの産生を誘導します。
また、NLRP3/cryopyrin、NLRC4/Ipafの経路を抑制する因子であるPyrinの変異は全身性炎症疾患である家族性地中海熱(FMF)を引き起こします。
CIITAの変異はMHCクラスII抗原の欠損症の原因になり、重篤な免疫不全を引き起こします。
Nod2 Crohn's disease L1007fsinsC, G908R, R702W Blau syndrome R334W, R334Q, L469F EOS R334W, D382E, H496L, M513T, T605P, N670K, NLRP3 CINCA R260W, D303N, Q306L, F309S,H358R, T436N, F573S, M662T MWS R260W, V198M, L305P, L353P, A352V, A439T, G569R FCAS R260W, V198M, L305P, L353P, A439V, E627G CIITA BLSII Δ24(IVSDS G-A), E381ter, W688ter, 991del, ΔI1027,Δ28(IVSDS G-A), L469P Pyrin FMF M697I, V726A, M680I, E167D, E148Q, P369S, R408Q, R653H, E148V, T267I, F479L, 1692del, K695R, A744S, R761H
このように、Nodファミリーと炎症性疾患の関連をみてもNodファミリーが病原に対する抵抗性に関わる自然免疫応答に重要であると考えられます。
Nod1とアレルギーと衛生仮説
Nod1の遺伝子多型によって、ある抗原に対して過剰なアレルギー反応を起こす病気であるぜんそく・アトピー性皮膚炎などのアレルギー性疾患のかかりやすさが変わってくることを述べました。
まず、アレルギー性疾患について考えてみましょう。
生体防御では、細菌や真菌にターゲットを絞って、特異的に排除するしくみ(Th1サイトカイン介在性応答)と、分泌性の非特異的なIgE抗体や粘液で異物を排除して体を守るしくみ(Th2サイトカイン介在性応答)があり、これらが拮抗しています。
昔から、細菌やその成分に触れ合う機会の少ない子供たちはアレルギー性疾患にかかりやすく、逆に触れる機会の多い子供たちはかかりにくいといわれます。これを衛生仮説といいます。これも、Th1とTh2のバランスの仕組みを考えると納得がいきます。
衛生のいい環境で、なぜアレルギー性疾患にかかりやすくなるのか、細菌のどの成分がアレルギーを抑えるのか、よくわかっていませんでした。
最近、Nod1遺伝子の差がぜんそくのかかりやすさに関係することがわかりましたが、おもしろいことに、細菌に触れやすい田園環境でだけNod1遺伝子の差が影響を与え、都市部では変わらないという研究が報告されました。
私たちはNod1刺激活性の高い細菌を探したところ、森林、草原や田園に多く住むBacillus 属の細菌がもっとも強いNod1刺激活性をもつことを見つけました。また、Nod1刺激成分は細菌の中にあるのではなくて、細菌の外に放出されるものであること、おそろしく安定な物質であることを見つけました。これらのことをあわせて考えるとNod1は、よく言えば自然豊かな環境、悪く言えば危ない病原細菌の多い環境にあることを体に教えているのかも知れません。体はそれによって、なんでもかんでも跳ね返す粘液やIgEといったアレルギー応答よりも、病原細菌だけに対する備えに体質が切り替わるのではないかと仮説が立てられます。
以上のように、Nod1を刺激することでぜんそくなどのアレルギー性疾患を予防できる可能性があります。まずは、今後、動物実験などでもっともっと調べていく必要があります。
Nod1、ASCとC.difficile感染症
C.difficileは偽膜性大腸炎を起こす病原菌です。現在アメリカでは年間約50万人が感染症にかかっており、その5%程度の患者が重症化し死に至ります。さらに、患者数、重症化は年々上昇する傾向にあり、大きな問題となっています。
C.difficileは健康な人も持っていることがあります。こうした健康な人の場合、C.difficileは他の細菌たちのために数が少なく保たれているだけではなく、私たちの免疫が毒素の働きを押さえ込んでいます。しかし、ある種の抗生物質を投与することにより常在細菌が減少、構成が変わると、C.difficileが増殖することがあります。 C.difficileは毒素を持っていて、腸を傷つけ、炎症を起こして大腸炎を起こします。
この時に体の中に侵入した常在細菌が全身に回ります。日ごろ悪さをしない常在細菌も体に入ると炎症を引き起こしたりと、より激しい症状を示すようになります。
常在細菌の体への侵入を防ぐのに好中球が障害を受けた腸患部に集まり細菌を除きます。
この好中球の呼び寄せにNod1がかかわっています。C.difficileのNod1刺激活性は大変強いことがわかりました。つまり、Nod1はC.difficileを認識し、ケモカインであるCXCL1、CXCL2を産生します。それにより好中球が感染部位に呼び寄せられます。
同時にC.difficile毒素によってIL-1bが分泌されます。これは好中球のCryopyrin/ASCのインフラマソームの活性化を介して起こります。このIL-1bはさらにCXCL1ケモカインを産生してさらに好中球を呼び寄せます。こうして正のフィードバックが誘導されます。
上の話と合わせると、こうして誘導された好中球は感染部位で常在細菌が全身に回るのを防ぐことで、全身性の炎症を引き起こすのを防いでいるのです。
Nod1と歯槽膿漏
Nod2とクローン病
クローン病とは腸が炎症を起こす病気です。炎症性腸疾患(IBD)には炎症性大腸炎(UC)とクローン病(CD)があります。患者数は増加傾向にあり、これは生活改善等の環境因子の影響によると考えられます。
ゲノムの解析から炎症性腸疾患になりやすくなる原因遺伝子(IBD感受性遺伝子)がたくさん見つかってきました。炎症性サイトカインTNFα、自然免疫で働くTLR4やNF-kBの調節因子IkBαの変異もクローン病の発症に影響を与えるといわれています。
このうち、最も研究が進んでいるのがIBD1=Nod2です。この多型は白人において多く認められています。
NOD2中の3変異が特にクローン病と関連します。一塩基変異R702W, G908Rと読み枠ずれ変異L1009fsInsCです。L1009fsInsCは読み枠ずれ直後に終始コドンが現れるので、結果的に不完全長の変異Nod2タンパク質ができます。これらの変異はMDPに対する応答性を消失または低下させます。
この機能欠損型対立遺伝子を持つヘテロザイゴートとホモザイゴートでは、健常型と比較してそれぞれ約1.5〜2倍、約40倍程度、罹患リスクが高くなります。
応答性が低下するのに、なぜ炎症が起こって病気になるのでしょうか?残念ながら、その答えはまだわかっていません。
中には、Nod2に変異を持ったマウスはMDPに対する応答性が亢進するということを報告している研究者たちもいますが、否定する報告が多くでています。
Nod2の変異によってTLR2を介した細菌成分に対する炎症性サイトカインの生産が亢進することが報告されていますが、これも否定する報告が多く疑問が残ります。
他の可能性として、Nod2変異による細菌に対する生体防御機構の欠損により、腸内における細菌除去が不完全になって、その繰り返しの結果、病変が起きるといった2段階のモデルが考えられます。実際、Nod2は腸上皮のパネート細胞でも恒常的に高発現しています。パネート細胞とは、ディフェンシンなどの抗細菌タンパク質の分泌を介して腸局所免疫で重要な役割を果たしていると考えられる細胞です。Nod2欠損マウスやCD患者ではパネート細胞からのαディフェンシンのレベルが低下していることが報告されています。
Nodタンパク質の機能異常によって引き起こされる炎症性疾患の病態はまだまだ不明な点があり、診断・治療といった観点から多くの課題を残しています。
先にもお話したように、Nod2の遺伝多型の影響はあくまで罹患率を規定するだけで、その変異多型による100%疾患を誘発するものではありません。細菌叢やそれに影響を与える環境因子、それに他の免疫調節系との相互作用がこれらの疾患発症に関わると考えられます。これらの研究は、疾患の予防や治療と結びつくと予想され、今後の展開が期待されます。
ちょこっとコラム〜マウスの結果は正しい?
Nod2のノックアウト、変異マウスの実験からさまざまな結果が出ています。マウスのバックグランド等、実験材料そのものの影響が考えられるのではないでしょうか。これに限らずですが、ラボ間で実験材料を交換して追試実験を行ったりする必要があるように思います。最近の傾向では「過剰発現系はけしからん」ですが、ノックアウトマウスでも間違った(アーティファクトの)結論をだす可能性は多いにあり、気をつける必要がありそうです。
細菌で病気を治す?
人の体には自分の細胞の2倍以上の細菌がいっしょに住んでいます。 そのほとんどが腸内。特に回腸(小腸の一部)から大腸にかけて住んでいます。
その種類も数千種(一人数百種類)で、人一人一人でかなり違います。 マイクロフローラと呼ばれています。 マイクロフローラはかなり安定で、少々のことでは変わりません。
最近、プロバイオティクス、プレバイオティクスという言葉を耳にする機会が多いと思います。 腸内に人にとって都合のいい細菌を入れてやって、健康に役立てようという考えです。
中でも腸内常在の乳酸菌類の有用性を考えて多くの研究がされています。 これらの細菌の中には整腸作用があったり、免疫活性効果があるものがあると言われています。これらについてはかなりの研究報告があり、腸内の「いわゆる善玉菌」が栄養源に利用できるが「いわゆる悪玉菌」は利用できない物質を、製剤や機能性食品として用いることが考案され、多くの製品が開発・実用化されいます。
ちなみに納豆の枯草菌は腸内では有意な数、生存できません。
しかし、これまでにも話したように、細菌そのものでなく、細菌から放出される何らかの成分にNod1は応答します。Nod1はNod2とほぼ同じしくみで免疫応答を起こします。これらのことを利用すると、Nod2の働きが弱ったクローン病の方でも 、Nod1を強く刺激してやることで、Nod2に代わって免疫応答を引き起こすことができると考えられます。このようにして、炎症性腸疾患の治療にも役立てていける可能性があります。
また、、先ほどお話したように、Nod1を刺激することでぜんそくなどのアレルギー性疾患にも予防できる可能性があります。
しかしながら、これらについては、まだまだ今後の研究を必要としています。
ちょこっとコラム〜乳酸菌は本当に効くの?
これらのデータは乳酸菌類が「有用」と考えた人たちによって得られたデータであって、「有用ではない」つまり効かないというデータが得られる研究ではないという問題点を常に持っています。 さらに、ヒトと同じマイクロフローラをもつモデル動物がない、というか、ヒトそれぞれが違うので、何をモデルにしていいのか、研究の限界があります。 つまり、調べる方法が限られているといえます。 だから、未だ、本当にそうだと言われるものがないのが現状です。
クローン病の患者さんへ
このホームページを見てくださったクローン病の患者さんから「クローン病の治療薬はいつ開発されるか」というような質問をいただきました。研究者として、一日でも早く病気の解明、治療薬の開発を目指したいところです。
(↓患者さんに対するメッセージです)
*****************************
CDの原因は今でも不明です。でも、CDの発症の過程で細菌に対する免疫が関わっているらしいことが、徐々にわかってきました。
今のところ、腸内での細菌排除する免疫細胞の機能や分布がおかしくなっていることがわかっていて、ごく最近、NOD2などの細菌を見つける遺伝子の機能異常でCDにかかりやすくなることが見つかったところです。ここ数年のCDの研究の進み方は、びっくりするぐらいです。これらの今までの発見を総合的に考えて、CDの病因を見つける次の段階の研究がまさに世界中で今進んでいます。とはいえ、アイデアの突然のひらめきや偶然の発見はいつあるのか予想できません。だから、ひょっとしたら明日でもわかるかもしれませんし、まだ何年も先かもしれません。
NOD2の変異が白人CD患者で見つかったときには、日本人でもその可能性が疑われましたが、実際に調べられてみると、日本人には変異自体は見つかりませんでした。一番最初の研究ではNOD2が細菌の見張り役として重要な単球細胞系にだけあるように見えたので、骨髄移植をすれば、CDは治るのではないかという期待が大いにもたれました。でも、NOD2は腸の細胞にもあったり、臓器移植の拒絶問題が絡んでいたりと、研究が進むにつれ、その治療法はむずかしいかもしれないことがわかりました。
このように、ひとつの発見を基礎として、新しい治療方法の考えが提唱されて、実際にうまくいくか、ひとつひとつ調べる必要があります。最終的に人での安全性まで調べられていく過程は、さらに、ちょっと時間がかかって、おそらく最低10年単位で考える必要があるんじゃないでしょうか。
なにはともあれ、CDは致死の病気ではないです。根気よく病状をよくして、病気を悪くしないようにすれば、治療法が見つかる日に会うのもそう遠くないような気がします。細菌感染症でたくさんの人が死んでいたのに、今では抗生物質が発見されてほとんど死病じゃなくなりました。ある日、いきなりCDの根本治療法が見つかる可能性があることを現在の研究は示しています。
でも、慢性気管支炎を見てわかるように、ふつうの気管支炎がずっと続いて、いったん炎症で体が変性しておかしくなると、治療がたいへん長引きます。だから、少しでも、「その日」まで、体をできるだけ良好な状態に保っておくのが大事じゃないかと思います。
どうか、もしも炎症があるなら、お薬でなるべく鎮めて、また日ごろから無理、体によくない食事、喫煙など、CDを悪くするような生活環境因子を排除されるようくれぐれも体をお労りになってくださいね。
研究課題〜私の夢
数年前までよくわからなかったNodファミリーの機能が、少しずつ解明されてきて、現在では大変ホット分野になりました。なこのような背景を踏まえて、さらにNodファミリーの機能解析や分子機構を解析していくとともに、Nodファミリーが与える生理的な役割について検討していきたいと考えています。Nodファミリーを中心とした自然免疫の役割を考えていくことで、炎症性疾患をはじめとするさまざまな病気の治療に役立てればいいなと思っています。
・・・そんな夢を抱いて、まだまだ遠いですが(笑)日々研究に励んでいます。
私の業績はこちら ないけど(^^;
最後に〜謝辞
毎日、私のつたない研究にもあきれず、ご指導してくださる猪原先生に心からお礼を申し上げます。
私のあこがれの師匠のホームページへ
また、大学院時代お世話になった須田先生ならびに研究室の皆様に感謝いたします。
私の故郷である分子標的薬剤開発センターのホームページへ
| Mizuho's home | PROFILE | My Diary | Ryu-gaku | My Band | ディスカッション広場 |